Organske spojine v vodi. Organske snovi v mineralnih vodah. Raztopljene mineralne soli
Naravne vode so lahko onesnažene z najrazličnejšimi nečistočami, ki jih glede na biološke in fizikalno-kemijske lastnosti delimo v skupine. V prvo skupino spadajo snovi, ki se topijo v vodi in so tam v molekularnem ali ionskem stanju (to sta dve različni podskupini). Druga skupina so tiste snovi, ki z vodo tvorijo suspenzije oziroma koloidne sisteme (tudi to sta dve različni podskupini). V koloidnem stanju so lahko mineralni ali organski delci, netopne oblike humusa in posamezni virusi. Suspenzije so največkrat plankton, bakterije in netopni drobni trdni delci.[...]
Vode odprtih rezervoarjev so onesnažene s humusnimi snovmi - kompleksnimi organskimi spojinami, katerih vsebnost v rečnih vodah je povprečno 5-10 mg / l, v jezerskih vodah pa od 1 do 150 mg / l. Naravne vode vsebujejo tudi koloidne, fine in grobe primesi. Opozoriti je treba tudi na biološko onesnaženje vodnih teles (mikroorganizmi, praživali, alge itd.).[...]
Naravne in odpadne vode so kompleksni večkomponentni sistemi, ki vsebujejo nečistoče različne fazno-disperzne sestave. Topne anorganske in organske spojine tvorijo enofazne raztopine z velikostjo delcev od 10-10 do 10-9m. Organske spojine z visoko molekulsko maso, raztopljene v vodi, lahko tvorijo koloidne raztopine. V koloidnem stanju so lahko tudi nekatere težko topne anorganske spojine, kot so alumosilikati, silicijeva kislina, hidroksidi težkih kovin itd.. Velikost delcev v koloidnih sistemih je 10 9-10 7 m. Glavnina težko topnih anorganskih in organskih spojine najdemo v vodi v obliki grobih nečistoč, ki tvorijo suspenzije ali emulzije z velikostjo delcev več kot 10 7 m. [...]
Organske snovi - produkti delnega razkroja odmrlih rastlin in živali, izločki vodnih živali in rastlin, huminske kisline in druge organske snovi, izprane iz tal, so skoraj vedno prisotne v naravnih vodah. Še posebej veliko jih je v vodi šotnih barij, voda rek, ki pritečejo iz takih barij, pa je zaradi organskih snovi navadno rumeno rjava. Z oksidacijo organske nečistoče absorbirajo raztopljeni kisik in lahko bistveno zmanjšajo njegovo koncentracijo v vodi. Poleg raztopljenih so v vodi prisotne tudi organske snovi v obliki odmrlih mikrobov, alg in drugih mikroskopskih organizmov.[...]
Vode v naravi nikoli ne najdemo v obliki kemično čiste snovi. Fizikalno in kemično sestavo naravnih voda običajno razumemo kot celoten kompleks raztopljenih plinov, ionov, suspendiranih snovi in koloidov mineralnega in organskega izvora. Približno polovica kemičnih elementov, vključenih v periodični sistem D. I. Mendelejeva, je bila najdena v naravnih vodah, mnogi drugi pa še niso bili najdeni samo zaradi nezadostne občutljivosti analiznih metod. Za odpadno vodo je značilna še večja kakovostna in količinska pestrost nečistoč; sestava teh nečistoč je v celoti odvisna od narave proizvodnje, v kateri nastanejo.[...]
V naravnih vodah so našli več kot polovico znanih kemičnih elementov. Po svoji naravi delimo nečistoče v vodi na mineralne in organske, ki se nahajajo v vodi v suspendiranem, koloidnem in resnično raztopljenem stanju.[...]
B Voda je kemična spojina vodika (11,11 %) in kisika (88,89 mas.). Čista voda je brez barve, vonja in okusa. Naravna voda je po svoji sestavi zelo raznolika. Njegova sestava vključuje soli (predvsem v obliki nenov, molekul in kompleksov), organske snovi (v molekularnih spojinah in v koloidnem stanju), pline (v obliki molekul in hidratiranih spojin), razpršene nečistoče, hidrobionte (plankton, bentos). , neuston, pagon ), bakterije, virusi.[...]
Če so v vodi organske spojine in njihovi kompleksi, ki vsebujejo železo, potem teh spojin ni mogoče vedno odstraniti s koagulacijo, še bolj pa pri obdelavi z železovimi solmi. V tem primeru pogosto v procesu vnosa koagulanta v vodo nastane veliko število fino razpršenih jeder, ki se sploh ne usedejo v usedalnike in se slabo zadržijo. V vseh primerih vnos kationov Fe2+ in Fe31 v naravno vodo povzroči nastanek močno obarvanih kompleksov kot rezultat njihove interakcije z organskimi spojinami, kar ima za posledico povečanje barve očiščene vode v primerjavi z izvirno. Ta pojav, ki ga opazimo pri obdelavi močno obarvane mehke vode z železovimi solmi, imenujemo "vrnitev barve", ki ga povzroči prehod obarvanih spojin dvovalentnega železa v spojine še bolj obarvanega železa, čeprav je treba opozoriti, da so soli dvovalentnega železa tudi sposoben tvoriti stabilne, slabo topne oblike s humusnimi snovmi. Iz tega sledi, da če železove soli dobro koagulirajo pri povišanem pH, potem organske spojine, ki tvorijo barvo, pridobijo najbolj stabilne oblike. Hkrati bolje koagulirajo pri nižjem pH = 5-6,5. To protislovje je eden od razlogov, ki pojasnjujejo popolnost koagulacije organskih nečistoč z železovimi solmi.[...]
Sestava naravnih voda se s časom običajno spreminja. Mineralne in organske snovi, suspendirane v vodi, se postopoma usedajo pod vplivom gravitacije. Nekatere organske snovi uporabljajo živi organizmi, ki naseljujejo vodna telesa, kot hranilni material. Kemični in biološki procesi, ki se pojavljajo v naravnih vodah, vodijo do uničenja zlahka oksidiranih organskih nečistoč. Nastajanje hidroksidov železa, mangana, aluminija in njihova vezava koloidnih primesi vode spreminja tudi njeno sestavo.[...]
Sestava nečistoč v naravni in odpadni vodi je ključnega pomena za izbiro metode njenega čiščenja. Vse snovi, ki so v vodi, lahko razdelimo na suspendirane in raztopljene. Po O. A. Alekin (Alekin, 1970) so raztopljene nečistoče naravnih voda razdeljene na organske snovi, glavne ione, elemente v sledovih, hranila in raztopljene pline. Razmislimo o glavnih sestavinah fizikalne in kemične sestave naravnih voda v skladu z dano klasifikacijo nečistoč.[...]
Rečne vode delimo na nizkomineralizirane (do 200 mg/l soli), srednjemineralizirane (200-500 mg/l) in visokomineralizirane (nad 1000 mg/l). Vode večine rek v Rusiji spadajo v prvi dve skupini. Voda poleg soli vsebuje tudi določeno količino kompleksnih naravnih organskih spojin - humusnih snovi. Vsebnost teh nečistoč v rečnih vodah je 5-10 mg/l, v jezerskih vodah pa do 150 mg/l.[...]
Motnost naravne vode je posledica prisotnosti neraztopljenih in koloidnih snovi anorganskega (glina, pesek, železov hidroksid) in organskega (mulj, mikroorganizmi, plankton, naftni derivati) izvora, tj. nečistoč, ki spadajo v prvo in drugo skupino glede na stopnje razpršenosti. Motnost merimo z različnimi metodami, ki temeljijo na primerjalni oceni preskusnega vzorca s standardno raztopino, katere motnost ustvarimo z dodajanjem standardne suspenzije silicijevega dioksida SiO2 destilirani vodi. Rezultati določanja motnosti so izraženi v mg/l. Motnost rečnih voda je večja kot v podzemnih vodah. V poplavnih obdobjih lahko motnost rečne vode doseže več deset tisoč miligramov na liter. V pitni vodi motnost po sanitarnih standardih, ki veljajo pri nas, ne sme biti višja od 1,5 mg/l.[...]
Oksidacijo organskih nečistoč v odpadni vodi v naravnih pogojih imenujemo naravno biološko čiščenje, oksidacijo z uporabo posebej zgrajenih naprav pa umetno biološko čiščenje.[...]
Oksidabilnost vode. Prisotnost v naravnih vodah organskih in nekaterih lahko oksidiranih anorganskih nečistoč (vodikov sulfid, sulfiti, železovo železo itd.) določa določeno stopnjo oksidativnosti vode.[...]
Oksidabilnost vode. Prisotnost organskih in nekaterih lahko oksidiranih anorganskih nečistoč (vodikov sulfid, sulfiti, železovo železo itd.) V naravnih vodah določa določeno stopnjo oksidabilnosti vode. Ker je oksidabilnost površinskih voda pojasnjena predvsem s prisotnostjo organskih snovi, je določanje oksidabilnosti, to je količine kisika, ki je potrebna za oksidacijo nečistoč v danem volumnu vode, ena od posrednih metod za določanje organske snovi v vodi.[ . . .]
Kakovost naravne vode razumemo kot celoto njenih lastnosti, ki jih določata narava in koncentracija nečistoč v vodi. Nečistoče v naravnih vodah delimo na anorganske in organske. Posebno skupino nečistoč sestavljata mikroflora in mikrofavna naravnih rezervoarjev, ki pomembno vplivata na kakovost vode.[...]
Analiza sestave organskih nečistoč v naravnih vodah, sorbiranih na površini aluminijevega hidroksida, nam omogoča, da jih uvrstimo med flokulante rastlinskega izvora. Prednost flokulantov naravnega izvora je, da nimajo strupenih lastnosti in so popolnoma neškodljivi za človeško telo. Na ta pojav opozarja tudi T. A. Karyukhina. Koloidne humusne snovi se sorbirajo na površini A1 ((ZN) h in nanjo prenesejo svoje lastnosti.[...]
Glavni del organskih nečistoč v naravnih vodah so humusne snovi. Poleg njih so tu še beljakovine, maščobe, ogljikovodiki, organske kisline in vitamini, ki pa predstavljajo le majhen delež celotne količine organskih spojin, ki jih najdemo v vodi.[...]
Čiščenje odpadne vode, kadar se uporablja za poplavljanje naftnih rezervoarjev. Trenutno zaradi krepitve ukrepov za sanitarno zaščito pred onesnaženjem naravnih rezervoarjev z oljem postaja uporaba odpadne vode rezervoarja za poplavljanje zelo pomembna. Vendar praksa kaže, da ta metoda daje visok učinek le, če voda, vbrizgana v naftni rezervoar, ne zamaši pore formacije v spodnjih conah vbrizgalnih vrtin in zagotavlja največjo absorpcijsko sposobnost v celotnem predvidenem obdobju vbrizgavanja. Da bi izpolnili to zahtevo, vbrizgana voda ne sme vsebovati več kot 1 mg/l mineralnih in organskih nečistoč, mora biti stabilna in ne sme proizvajati usedlin v conah dna vrtine po mešanju s proizvedeno vodo v naftonosni formaciji; ne sme povzročati korozije; vsebnost olja mora biti nižja od 1 mg/l; poleg tega mora imeti voda visoko sposobnost odvajanja olja.[...]
Metode za odstranjevanje organskih snovi iz vode lahko razdelimo v dve skupini: oksidativne in adsorpcijske.Klor, ozon in kalijev permanganat se uporabljajo kot oksidanti za organske nečistoče v naravnih vodah, torej reagenti, ki se uporabljajo tudi za dezinfekcijo vode.V procesu čiščenja vode s klorom potekajo predvsem oksidacijske in substitucijske reakcije, ki jih ob optimalnem odmerku oksidanta spremlja tvorba spojin brez vonja, barve in okusa. Klor zlahka oksidira aldehide, alkohole, aminokisline in deluje na nekatere sestavine ki povzročajo obarvanost vode (železovi apokrati). "železa manj oksidirajo s klorom. Razbarvanje vode poteka najbolj učinkovito pri pH 7,5-8,0, pri čemer imata glavno vlogo hipoklorova kislina in hipokloritni ion, ki nastane pri hidrolizi klora v vodi. Organske nečistoče se oksidirajo šele, ko bo oksidacijski potencial vnesenega reagenta zadosten za potek reakcije z organsko snovjo. Tako uporaba klora ni vedno učinkovita za oksidacijo snovi, ki povzročajo vonjave in okuse v vodi. Količina klora, potrebna za njihovo oksidacijo, je večja od optimalne doze klora za dezinfekcijo vode.[...]
Za identifikacijo organskih nečistoč z IR spektri v naravnih in odpadnih vodah po njihovi ločitvi in izolaciji s kemičnimi metodami je bila izbrana možnost IPS z banko podatkov, ki vsebuje opis omejenega števila organskih spojin, standardiziranih kot onesnaževala vode, ter nekaterih drugih najpogostejše organske spojine (slika 1). Ta možnost ima dve glavni prednosti v primerjavi s sistemi za iskanje informacij, ki imajo velike podatkovne banke: prvič, lahko uporabite majhen računalnik z relativno majhno količino pomnilnika, ki je bolj dostopen in poceni; drugič, poveča se hitrost iskanja in zanesljivost identifikacije povezave, saj se kot odgovor na zahtevo posredujejo podatki za majhno število povezav s podobnimi lastnostmi.[...]
Za ovrednotenje pitne vode je pomembno, da razumemo količino organskih snovi, ki jih vsebuje, in naravo teh snovi. Najprej je pomembna toksičnost organskih nečistoč, ki lahko pridejo v naravno vodo skupaj z nekaterimi industrijskimi odpadnimi vodami. V tabeli Dodatek 2 1 podaja sanitarne in toksikološke značilnosti nekaterih organskih snovi v industrijskih odpadnih vodah.[...]
Za čiščenje odpadnih voda se uporabljajo umetni in naravni mineralni in organski kationski izmenjevalci. Mineralni kationski izmenjevalci se kljub nizki ceni zaradi svoje nizke izmenjevalne zmogljivosti in nezadostne trajnosti ne uporabljajo široko, čeprav se nekateri od njih (na primer vermikulit, mongmorilonit, dolomit) priporočajo za čiščenje odpadne vode pred radioaktivnimi nečistočami. Pogosteje se uporabljajo organski umetni močni kislinski (KU-1, KU-2, sulfonatni premog, Vofatity itd.) In šibko kislinski (KB-4, SG-1, Amberlight itd.) Kationski izmenjevalci. Značilnosti nekaterih kationskih izmenjevalcev so podane v tabeli. 6.3.[...]
Absorpcija klora v vodi - absorpcija klora z nečistočami v vodi. V naravni vodi se del klora porabi za oksidacijo organskih in mineralnih nečistoč, zato ima lahko odvisnost preostalega klora od vnesenega klora drugačno obliko (glej sliko.[...]
Ko taka podtalnica postane površinska voda, ogroža povečana vsebnost organskih primesi v njej. Medtem ko imajo naravna onesnaževala, kot so odpadlo listje in ostanki dreves, manjšo vlogo, so gospodinjske, kmetijske in industrijske odpadne vode vir nevarnosti. Zaradi široko razvejanega kanalizacijskega sistema odtekajo gospodinjske in industrijske vode z vsemi nečistočami predvsem v površinske vode.[...]
Pri obdelavi močno obarvanih naravnih voda je treba uporabiti kavstično sodo (natrijev hidroksid) in sodo (natrijev karbonat) za alkalizacijo vode, ki ne vsebuje hidroksidnih kosmičev s sorbiranimi organskimi snovmi. Ker apna (kalcijevega oksida) ni mogoče dodati prečiščeni vodi, ga je treba dodati na tistih mestih čistilnih naprav, kjer je voda osvobojena večine kosmičev in barvil. Kredo lahko zaradi manjšega stabilizacijskega učinka na organske primesi vnašamo v vodo po končanem procesu koagulacije in sorpcije barvnih snovi na nastale hidrokside, ne da bi čakali na njihovo odstranitev iz vode.[...]
Biološko čiščenje odpadne vode igra pomembno vlogo pri osvobajanju vode organskih in nekaterih mineralnih onesnaževalcev. Podobno je naravnemu procesu samočiščenja vodnih teles. Bioremediacijo izvaja združba organizmov, ki jo sestavljajo različne bakterije, alge, glive, praživali, črvi itd. Proces čiščenja temelji na sposobnosti teh organizmov, da uporabljajo raztopljene nečistoče za prehrano, rast in razmnoževanje.[. ..]
Narava interakcije organskih nečistoč z vonjem v naravnih vodah s klorom ali njegovimi derivati je zelo zanimiva, saj je klor reagent, ki se pogosto uporablja pri pripravi vode za pitje.[...]
Vibracijska stanja vodnih molekul, odgovornih za Ramanovo sipanje, imajo relaksacijski čas 10"'1 s, zato je Ramanov signal linearno povezan z intenzivnostjo vznemirljivega sevanja v zelo širokem razponu. Pri prilagajanju valovne dolžine sevanja za optimalno vzbujanje fluorescenčne nečistoče se lahko zaradi fiksnega premika Ramanove črte glede na vznemirljivo sevalno črto normalizira Ramanov signal v širokem spektralnem območju.[...]
Za skupno določanje organskih snovi v odpadnih vodah so razvili vrsto instrumentov in tehnik: hitra metoda (občutljivost manj kot 2 mg/l), ki temelji na oksidaciji organskih snovi s kisikom; instrument izboljšane zasnove, ki omogoča neposredno in natančno določanje majhnih količin ogljika (občutljivost 0,5 mg/l); analizator za kontinuirano avtomatsko določanje organskega ogljika v vodi in odpadni vodi, ki opravlja tri funkcije: 1) predhodno čiščenje vzorca odpadne vode za odstranitev anorganskih spojin; 2) oksidacijo organskih primesi in 3) kvantitativno določanje ogljikovega dioksida; avtomatska naprava z napravo za kontinuirano analizo, ki omogoča določanje tako organskega ogljika kot KPK v enem delovnem ciklu iz enega vzorca; naprava za analizo vode v rezervoarjih, ki omogoča določanje skupne koncentracije ogljika v vodi in koncentracije ogljika v organskih nečistočah (občutljivost 1 mg/l, eno določanje traja 2 minuti). Po podatkih se v naravnih vodah samodejno določa skupni ogljik - 20 vzorcev na uro, občutljivost 0,2 mg/l. Po podatkih avtomatski instrumenti sočasno določajo organski ogljik in KPK v 2-3 minutah v vzorcih vode in odpadne vode od nekaj deset mililitrov do več deset mikrolitrov. Vzorci vode so predhodno uparjeni in po koncentraciji sežgani pri 1000°C v zračnem toku v prisotnosti katalizatorja.[...]
Na podlagi analize vzorcev, ki vodijo procese čiščenja vode, je kontaminante združil glede na njihovo fizikalno in kemijsko stanje v vodi, ki je v določeni meri odvisno od razpršenosti snovi. Ta princip je omogočil združevanje v manjše število skupin po kemijskih in fizikalnih lastnostih najrazličnejših primesi naravne in odpadne vode. Na podlagi tega so vse snovi razdeljene v štiri skupine: dve heterogeni, v katerih se delci ne premešajo popolnoma z vodo, in dve homogeni, ki z vodo dajeta prave raztopine. Te skupine so: 1) suspenzije, 2) koloidne raztopine, 3) organske molekule in raztopljeni plini, 4) elektroliti.[...]
V skladu z osnovami vodne zakonodaje ZSSR, s pravili za zaščito površinskih voda pred onesnaženjem z odpadno vodo (št. 1166-74) in v skladu z /104-107/, je treba odvajanje odpadne vode v naravne objekte izvajati. nadzorovano. V odpadno vodo ni dovoljeno odvajati škodljivih nečistoč, katerih koncentracije presegajo mejne koncentracije za naravne vode. Hidravlične lastnosti (temperatura, pH, mineralna sestava, suspendirane in organske snovi) ne smejo presegati določenih vrednosti; vrednosti, ki ustrezajo značilnostim reke ali rezervoarja, v katerega se to namakanje izvaja (Tabela 55).[...]
Glede na vsebnost suspendiranih snovi in obarvanih humusnih spojin ločimo močno motne in močno obarvane vode. Naravne vode vsebujejo poleg obarvanih organskih primesi tudi brezbarvne organske snovi – odpadke mikroorganizmov in spojine, ki prihajajo z odpadno vodo.[...]
V knjigi so predstavljena dela, objavljena v literaturi, ter avtorjeve raziskave o preučevanju narave in lastnosti organskih primesi v vodi, ki določajo njene organoleptične lastnosti, ter opisane obstoječe; podane so metode čiščenja vode in njihova primerjalna ocena, predlagane so metode čiščenja naravnih voda s poslabšanimi organoleptičnimi lastnostmi. [...]
Poleg uporabe obstoječih metod, izboljšave znanih fizikalnih, kemijskih in bioloških metod čiščenja naravnih in odpadnih voda pred škodljivimi primesi, ki jih vsebujejo, je nujen razvoj novih metod. V zvezi z navedenim si zasluži posebno pozornost razvoj principov uporabe materialov z adsorpcijskimi lastnostmi. Uporaba materialov z adsorpcijskimi lastnostmi ali povečano adhezivno aktivnostjo bo omogočila izboljšanje metod čiščenja vode za odstranjevanje iz vode ne le mineralnih in organskih nečistoč skupin I in II. Uporaba zgoraj navedenih materialov je po našem mnenju morda najbolj realen način za rešitev problema dezinfekcije vode pred odpornimi oblikami patogenih mikroorganizmov. [...]
Določanje površinskih o-aktivnih snovi v sledovih s polarografijo (374). Določanje metil metakrilata v vejicah s polarografijo (370). Določanje nizkih koncentracij nitroinkloheksana v odpadni vodi s polarografijo (377). Določanje krezolov v odpadnih vodah s polarografijo (379). Določanje benzena v odpadni vodi s polarografijo (380). Določanje maleinske, fumarne in ftalne kisline v odpadnih vodah s polarografijo (331). Določanje nizkih vsebnosti organskih primesi v industrijskih odpadnih vodah z ekstrakcijsko-polarografsko metodo (382). Določanje NPT spojin v odpadni vodi s polarografijo (384). Določanje anionskih, kationskih in neionskih površinsko aktivnih snovi (PAS) v odpadnih vodah s polarografsko metodo »385). Določanje nitratov v odpadnih vodah s polarografijo (387). Določanje jodidov v odpadnih vodah s polarografijo (388). Določanje arzena (111) v odpadni vodi s polarografijo (389). Določanje svinca in živega srebra v odpadnih vodah industrijskih podjetij s polarografijo (390). Določanje aluminija, železa, bakra, kadmija, cinka, kobalta, niklja, titana, kroma, mangana v odpadni vodi iz enega vzorca s polarografijo in fotoelektrokolorimetrijo (392). Določanje natrija v naravnih vodah s polarografijo (394). Določanje bakra, cinka in kadmija v morski vodi, industrijskih in odpadnih vodah z adsorpcijsko-polarografsko metodo (395). Določanje cinka v odpadni vodi s polarografijo (396). Določanje bakra v odpadni vodi s polarografijo (398). Določanje niklja v odpadni vodi s polarografijo (401). Določanje bakra, svinca, kadmija in cinka v vodi iz enega vzorca s polarografijo z izmeničnim tokom (403).[...]
Prisotnost povezave med onesnaženostjo okolja in boleznimi prebivalstva vodi do potrebe po kvalitativnem in kvantitativnem določanju organskih nečistoč v vodi, ki zlasti nastajajo kot nezaželeni stranski produkti pri dezinfekciji s klorom ali ozonom. Očitno glavnino organskih snovi v naravnih in odpadnih vodah sestavljajo spojine z nizko hlapnostjo, predvsem huminske snovi.[...]
Polarografska metoda analize je boljša od kolorimetrične metode, na primer pri določanju formaldehida, insekticida Nemagon in številnih drugih organskih spojin. Poleg metod APN in klasične polarografije se za analizo naravnih in odpadnih voda na vsebnost organskih sestavin uporabljajo pulzne in oscilopolarografske metode, ki lahko bistveno (do 10 6 mol/l) povečajo občutljivost določitev. Raziskano je bilo polarografsko in pulznopolarografsko obnašanje številnih trialkil-substituiranih kositrovih spojin in razvite so bile metode za njihovo določanje v odpadni vodi. V delih je opisano veliko dela pri izbiri pogojev za oscilopolarografsko določanje številnih spojin (tiuram, formaldehid, cinkov stearat, anilin in kaprolaktam). Avtomatizirane metode za določanje številnih organskih nečistoč lahko temeljijo na principih oscilopolarografije z neposrednim tokom.[...]
Specialist ameriškega geološkega zavoda F. D. Sisler je proučeval biokemične procese, ki se dogajajo v morskih globinah, kjer bakterije uporabljajo vodik, ki ga vsebuje voda. V naravnih razmerah se energija, ki jo proizvede ta velikanski generator goriva, razprši. Na podlagi teh opazovanj je bila izdelana laboratorijska naprava iz dveh delov - anode in katode, katerih elektrodi sta ločeni z ionsko-difuzijskim mostom. V anodni del smo vlili mešanico morske vode in organskih nečistoč (koruznih storžev, žagovine itd.), obogateno s kolonijami mikroorganizmov. Katodni del je bil napolnjen z morsko vodo, obogateno s kisikom.[...]
Delo Uglova, Lazareva in Aleksandrova o baktericidnem učinku majhnih koncentracij srebrovih soli je potrdilo potrebo po dolgotrajnem stiku vode s posrebrenim peskom pri uporabi slednjega za dezinfekcijo. Pomembna pomanjkljivost te metode ni le trajanje procesa obogatitve vode s srebrom, temveč tudi nezmožnost nadzora zaradi dejstva, da je hitrost raztapljanja kovine odvisna od stanja njene površine, sestave soli, organske primesi naravne vode ipd. Pri proizvodnji srebrne vode po tej metodi ni mogoče dozirati srebra in kontrolirati procesa.[...]
Tako sta sedimentacija mineralnih delcev v odsekih reke s počasnim tokom ali nasičenost hladnih, viharnih gorskih rek s kisikom povsem fizikalna procesa. Regulacija ionske sestave naravnih voda poteka tako po fizikalno-kemičnih kot po bioloških poteh. Tvorba netopnih spojin, stalni tok, procesi ionske izmenjave, neposredna oksidacija organskih snovi z raztopljenim kisikom so v bistvu fizikalni in kemijski procesi. Hkrati vodna vegetacija aktivno absorbira fosfatne in nitratne ione, izvaja aktivno izmenjavo plinov, absorbira številna hranila iz vode in jih vnaša v trofične mreže vodnih ekosistemov. Mikroorganizmi imajo vodilno vlogo pri oksidaciji organskih nečistoč.[...]
Pri analizi zelo zapletenih zmesi, ko je identifikacija komponent samo s plinsko kromatografijo težavna, se lahko uporabi kombinacija plinske kromatografije in. masna spektrometrija - plinska kromatografija-masna spektrometrija. Uporaba takšne kombinacije za določanje sestave organskih nečistoč v naravnih in odpadnih vodah je opisana v številnih delih, ki zahtevajo posebno obravnavo.[...]
Posebnost naprav za reverzno osmozo je preprostost njihove zasnove in delovanja, odstranitev nekaterih organskih nečistoč in površinsko aktivnih snovi ter naravne onesnažene vode iz vode.
Usoda onesnaževal v naravnih vodah je različna. Težke kovine, ko so v rezervoarju, se porazdelijo v različnih oblikah, nato pa jih postopoma odnašajo s tokom, zajamejo talni sedimenti ali absorbirajo vodni organizmi (predvsem z vezavo na SH skupine), s katerimi se usedejo na dno. , različne oblike težkih kovin pa se absorbirajo v različnih stopnjah.
Naftni produkti se praktično ne mešajo z vodo in se razprostirajo po njeni površini v tankem filmu, ki ga odnesejo tokovi in se sčasoma adsorbirajo na suspendirane delce in se usedejo na dno. Raztopljeni naftni derivati se tudi adsorbirajo na suspendirane delce ali oksidirajo s kisikom, raztopljenim v vodi, razvejani ogljikovodiki pa oksidirajo hitreje kot nerazvejeni. Naftne derivate lahko absorbirajo tudi vodni mikroorganizmi, vendar je tukaj ravno nasprotno: razvejani se absorbirajo počasneje.
Površinsko aktivne snovi se adsorbirajo na suspendirane delce in se usedejo na dno. Lahko jih tudi razgradijo nekateri mikroorganizmi. Nekatere površinsko aktivne snovi tvorijo netopne soli s kalcijem in magnezijem, ker pa se takšne površinsko aktivne snovi v trdi vodi slabo penijo, jih poskušajo nadomestiti s snovmi, ki ne tvorijo netopnih soli. Obnašanje površinsko aktivnih snovi, ki ne tvorijo netopnih soli, je v glavnem opisano s kinetičnimi modeli z uporabo efektivnega linearnega pretoka od vodnega stolpca do dna.
Gnojila, ko so v vodnem telesu, običajno absorbirajo živi organizmi, močno povečajo biomaso, vendar se na koncu še vedno usedejo na dno (čeprav jih je mogoče delno izvleči nazaj iz talnih usedlin).
Večina organskih snovi, vključno s pesticidi, je hidrolizirana, oksidirana z raztopljenim kisikom ali (nekoliko redkeje) vezana s huminskimi kislinami ali ioni Fe 3+. Nekateri mikroorganizmi lahko spodbujajo tako oksidacijo kot hidrolizo. Snovi, ki vsebujejo žveplo v nizkih stopnjah oksidacije, dvojne vezi in aromatične obroče z donorskimi substituenti, so podvržene oksidaciji. Atomi ogljika, vezani na kisik, in atomi ogljika na polariziranih vezeh so tudi oksidirani:
Spojine, ki vsebujejo halogene, pa tudi aromatske spojine z meta-orientirajočimi substituenti (na primer skupina NO 2) in halogeni se oksidirajo veliko počasneje kot njihovi nesubstituirani analogi. Skupine, ki vsebujejo kisik v molekuli ali o, n - orientacijski substituenti (razen halogenov) v aromatskem obroču, nasprotno, pospešijo oksidacijo. Na splošno je relativna stabilnost spojin na oksidacijo v vodi približno enaka kot v atmosferi.
Spojine, ki vsebujejo polarne vezi ogljik-halogen, se hidrolizirajo najprej, estrske vezi so veliko počasnejše, vezi C–N pa še počasneje.

Povečanje polarnosti vezi povzroči pospešitev hidrolize. Večkratne vezi, kot tudi vezi z aromatskim obročem, praktično niso hidrolizirane. Slabo hidrolizirane so tudi spojine, v katerih en atom ogljika vsebuje več atomov halogena. Če zaradi hidrolize nastanejo kisline, potem povečanje pH praviloma spodbuja ta proces; če nastanejo baze, znižanje pH prispeva k večji hidrolizi. V močno kislem okolju se pospeši proces hidrolize vezi C–O, upočasni pa se hidroliza vezi ogljik–halogen.
Tako oksidacijo kot hidrolizo organskih spojin opisujemo s kinetičnimi modeli in ju lahko označimo z razpolovno dobo teh spojin. Hidrolizo, katalizirano s kislinami in bazami, opisujejo bolj zapleteni modeli, saj je njena hitrost zelo odvisna od pH (slika).

To odvisnost običajno izrazimo z enačbo
k = k n + k а * 10 - pH + k b £„ * 10 14 –рН,
kjer je k skupna konstanta hitrosti hidrolize, k n je konstanta hitrosti hidrolize v nevtralnem mediju, k a je konstanta hitrosti hidrolize, katalizirane s kislino, k b je konstanta hitrosti hidrolize, katalizirane z bazo.
Produkti oksidacije in hidrolize so praviloma manj nevarni za organizme kot prvotne snovi. Poleg tega se lahko nadalje oksidirajo v H 2 O in CO 2 ali pa jih absorbirajo mikroorganizmi. V hidrosferi je bolj verjetna druga pot. Kemično stabilne organske snovi sčasoma končajo v pridnenih usedlinah zaradi adsorpcije na suspenzijah ali absorpcije mikroorganizmov.
V vseh rezervoarjih so efektivni linearni pretoki raztopljenih snovi na dno običajno precej manjši od 10 cm/dan, zato je ta način čiščenja rezervoarjev precej počasen, a zelo zanesljiv. Organske snovi, ujete v pridnenih usedlinah, običajno uničijo v njih živeči mikroorganizmi, težke kovine pa se pretvorijo v netopne sulfide.
Na temo: Kemična sestava naravne vode
Organske snovi v vodi
Poleg anorganskih spojin, ki so po kemični sestavi razmeroma enostavne in so v naravnih vodah raztopljene v obliki ionov in plinov, so v vodi skoraj vedno prisotne organske snovi.
Organske snovi, ki jih najdemo v naravni vodi po svoji naravi lahko razdelimo na:
Del živih organizmov, ki naseljujejo vodo (številni vodni organizmi: zoo- in fitoplankton ter različni mikroorganizmi);
Organska snov, ki je produkt razpada živih organizmov (po kompleksnosti kemijske sestave in zgradbe je vmesna med živimi organskimi snovmi in enostavnimi anorganskimi spojinami).
Organska snov naravnih voda je kompleks resnično raztopljenih in koloidnih snovi organskih spojin.
Organske snovi po izvoru naravne vode lahko razdelimo na:
Prihaja od zunaj (iz prispevnega območja);
In nastala v samem vodnem telesu. To so produkti smrti vodnih organizmov v samem rezervoarju.
Prva skupina (ki prihaja od zunaj) vključuje predvsem:
Huminske snovi, ki jih voda izpere iz prsti, šotišč, gozdnega humusa in drugih vrst naravnih formacij, vključno z rastlinskimi ostanki;
Organske snovi iz industrijske in gospodinjske odpadne vode.
Od huminskih snovi sta najbolj zanimivi huminska in fulvinska kislina. Obe kislini sta značilni za humus (huminske kisline). V živih rastlinskih in živalskih tkivih jih ni. Razmerje med njima je v različnih šotah in tleh različno. V černozemskih tleh prevladujejo huminske kisline, v podzolatih pa fulvokisline. Huminske snovi vključujejo tudi karboksilne kisline z nizko molekulsko maso: ocetna, citronska, vinska, oksalna, fumarna.
Huminske kisline ne le zakisujejo vodo v rezervoarju, ampak so sposobne tvoriti kompleksne spojine s težkimi kovinami, predvsem z železom.
To se zgodi na naslednji način
V šotnih barjih spojine železovega oksida prehajajo v anaerobno cono in kislo okolje (saj močvirne vode vsebujejo CO 2). Fulvične kisline, prisotne v šotnem barju, lahko reducirajo železov oksid v oksid, ki je nato izpostavljen ogljikovemu dioksidu in se raztopi. To pomeni, da železovo železo (Fe 2+) preide v raztopino predvsem v obliki železov bikarbonat, ki je stabilen le, če vsebuje velike količine CO 2 in pomanjkanje kisika.
Tako nastanejo kompleksi železovih spojin z organskimi kislinami, kot so citronska, oksalna in zlasti huminska.
Z zniževanjem CO 2 in manifestacija raztopljenega kisika, ki se na primer zgodi, ko močvirna voda teče v reke, železo se spremeni v rahlo topen dušikov hidrat, kar lahko shematično predstavimo z enačbo:
Fe 2+ + 2HCO 3 - Fe(OH) 2 + 2CO 2.
4Fe(OH) 2 + O 2 + 2H 2 O  4 Fe(OH) 3 .
4 Fe(OH) 3 .
Proces oksidacije Fe(OH) 2 v mnogih primerih poteka s sodelovanjem mikroorganizmov, imenovanih železove bakterije.
Skupna koncentracija organske snovi v naravnih vodah se zelo razlikuje:
Največja je v močvirnih vodah (v katerih ob visoki koncentraciji humusnih snovi včasih doseže 500 mg/l ali več) in rekah, ki se napajajo iz močvirij. Poleg tega je močvirna voda lahko obarvana rumeno in rjavo (huminske kisline dajejo barvo naravni vodi). V rekah, ki jih napajajo močvirja, so snovi humusnega izvora glavni del kemične sestave vode;
Visoke koncentracije organske snovi so včasih v podzemni vodi, povezani z naftnimi polji;
Še večje koncentracije se lahko pojavijo v naravnih vodah, onesnaženih z industrijsko in gospodinjsko odpadno vodo;
V hladnih podnebnih območjih (tundra) je zelo malo organskih ostankov in tam vodna telesa skoraj ne vsebujejo huminskih kislin. In v gozdnem območju, zlasti iglavcev, kjer nastane veliko organskih ostankov in nimajo časa za popolno razgradnjo, je vsebnost huminskih kislin več deset miligramov na liter.
Neonesnažene naravne vode običajno vsebujejo malo organskih snovi. Na primer, po B.A. Skopincev, je v oceanski vodi koncentracija organske snovi le 2,0-5,4 mg/l (v povprečju 3,0 mg/l, v rečni vodi pa v povprečju 20 mg/l).
Po vstopu v dobro prezračevane reke, nato pa v jezera in morja, se organske snovi vode spremenijo in proces oksidacije, ki se je začel v tleh, se za večino konča s prehodom v preproste mineralne spojine. Drugi, stabilnejši del ostane in se kopiči v vodnih telesih.
Organski ogljik
Organski ogljik je najbolj zanesljiv pokazatelj skupne vsebnosti organskih snovi v naravnih vodah, v povprečju predstavlja okoli 50 % mase organskih snovi.
Sestava in vsebnost organskih snovi v naravnih vodah je določena s kombinacijo številnih procesov, ki se razlikujejo po naravi in hitrosti: posmrtni in intravitalni izločki vodnih organizmov; vnosi s padavinami, s površinskim odtokom kot posledica interakcije atmosferskih voda s tlemi in vegetacijo na površini prispevnega območja; prejemki iz drugih vodnih teles, iz močvirij, šotnih barij; prejemki iz gospodinjskih in industrijskih odpadnih voda.
Koncentracija organskega ogljika je podvržena sezonskim nihanjem, katerih naravo določajo hidrološki režim vodnih teles in s tem povezane sezonske spremembe kemične sestave ter začasne spremembe v intenzivnosti bioloških procesov. V spodnjih plasteh rezervoarjev in površinskem filmu se lahko vsebnost organskega ogljika bistveno razlikuje od njegove vsebnosti v preostali vodi.
Organske snovi se nahajajo v vodi v raztopljenem, koloidnem in suspendiranem stanju in tvorijo določen dinamičen sistem, na splošno neravnovesen, v katerem se pod vplivom fizikalnih, kemičnih in bioloških dejavnikov neprekinjeno izvajajo prehodi iz enega stanja v drugega.
Ogljikovodiki (naftni derivati)Naftni derivati so med najbolj pogostimi in nevarnimi snovmi, ki onesnažujejo površinske vode. Nafta in njeni produkti so izjemno kompleksna, nestabilna in raznolika mešanica snovi (nizko- in visokomolekularni nasičeni, nenasičeni alifatski, naftenski, aromatski ogljikovodiki, kisikove, dušikove, žveplove spojine, pa tudi nenasičene heterociklične spojine, kot so smole, asfalteni , anhidridi, asfaltne kisline). Koncept "naftnih proizvodov" v hidrokemiji je običajno omejen le na frakcijo ogljikovodikov (alifatski, aromatski, aliciklični ogljikovodiki).
Velike količine naftnih derivatov pridejo v površinske vode pri transportu nafte po vodi, z odpadno vodo iz naftne, rafinerijske, kemične, metalurške in drugih industrij ter z gospodinjskimi vodami. Nekatere količine ogljikovodikov pridejo v vodo kot posledica intravitalnih izločkov rastlinskih in živalskih organizmov, pa tudi zaradi njihove postmortalne razgradnje.
Zaradi procesov izhlapevanja, sorpcije, biokemične in kemične oksidacije, ki potekajo v rezervoarju, se lahko koncentracija naftnih derivatov znatno zmanjša, njihova kemična sestava pa se lahko bistveno spremeni. Najbolj stabilni so aromatski ogljikovodiki, najmanj pa n-alkani.
Naftni derivati se nahajajo v različnih migracijskih oblikah: raztopljeni, emulgirani, sorbirani na trdnih delcih suspenzij in sedimentov na dnu, v obliki filma na površini vode. Običajno je v trenutku vstopa masa naftnih derivatov koncentrirana v filmu. Z oddaljevanjem od vira onesnaženja pride do prerazporeditve med glavnimi oblikami migracije, ki je usmerjena v povečanje deleža raztopljenih, emulgiranih in sorbiranih naftnih derivatov. Količinsko razmerje teh oblik določa kompleks dejavnikov, med katerimi so najpomembnejši pogoji za vstop naftnih derivatov v vodno telo, oddaljenost od mesta izpusta, hitrost pretoka in mešanje vodnih mas. , naravo in stopnjo onesnaženosti naravnih voda, pa tudi sestavo naftnih derivatov, njihovo viskoznost, topnost, gostoto, vrelišče komponent. Med sanitarno-kemičnim nadzorom se praviloma določi količina raztopljenih, emulgiranih in sorbiranih oblik olja.
Škodljivi učinki naftnih derivatov na različne načine vplivajo na človeško telo, divje živali, vodno vegetacijo ter fizično, kemično in biološko stanje rezervoarja. Alifatski, naftenski in zlasti aromatski ogljikovodiki z nizko molekulsko maso, ki jih vsebujejo naftni derivati, imajo toksičen in do neke mere narkotičen učinek na telo, kar vpliva na srčno-žilni in živčni sistem. Največjo nevarnost predstavljajo policiklični kondenzirani ogljikovodiki, kot je 3,4-benzapiren, ki imajo rakotvorne lastnosti. Naftni derivati ovijejo perje ptic, površino telesa in organe drugih vodnih organizmov, kar povzroča bolezni in smrt.
Negativen vpliv naftnih derivatov, predvsem v koncentracijah 0,001-10 mg/dm3, in njihova prisotnost v obliki filma vpliva tudi na razvoj višje vodne vegetacije in mikrofitov.
V prisotnosti naftnih derivatov voda pridobi specifičen okus in vonj, spremenita se njena barva in pH, poslabša se izmenjava plinov z ozračjem.
MetanMetan spada med pline biokemičnega izvora. Glavni vir njegovega nastanka so razpršene organske snovi v kamninah. V svoji čisti obliki je včasih prisoten v močvirjih, ki nastanejo med gnitjem močvirne vegetacije. Ta plin v naravnih vodah je v molekularno razpršenem stanju in ne vstopa v kemično interakcijo z vodo.
Benzen
Benzen je brezbarvna tekočina z značilnim vonjem.
Benzen vstopa v površinske vode iz podjetij in proizvodnje osnovne organske sinteze, petrokemične, kemično-farmacevtske industrije, proizvodnje plastike, eksplozivov, ionskih izmenjevalnih smol, lakov in barv, umetnega usnja, pa tudi z odpadno vodo iz tovarn pohištva. V odpadnih vodah koksarn je benzen v koncentracijah 100-160 mg/dm3, v odpadnih vodah proizvodnje kaprolaktama - 100 mg/dm3, v odpadnih vodah proizvodnje izopropilbenzena pa do 20.000 mg/dm3. Vir onesnaževanja vode je lahko transportna flota (uporablja se v motornem gorivu za povečanje oktanskega števila). Benzen se uporablja tudi kot površinsko aktivna snov.
Benzen hitro izhlapi iz vodnih teles v ozračje (razpolovna doba je 37,3 minute pri 20°C). Mejna vrednost vonja benzena v vodi je 0,5 mg/dm3 pri 20°C. Pri 2,9 mg / dm3 je vonj označen z intenzivnostjo 1 točke, pri 7,5 mg / dm3 - za 2 točki. Ribje meso dobi pri koncentraciji 10 mg/dm3 neprijeten vonj. Pri 5 mg/dm3 smrad izgine v enem dnevu, pri 10 mg/dm3 se intenzivnost smradu na dan zmanjša na 1 točko, pri 25 mg/dm3 pa se vonj zmanjša na 1 točko po dveh dneh.
Okus pri vsebnosti benzena v vodi 1,2 mg/dm3 se meri kot 1 točka, pri 2,5 mg/dm3 - kot 2 točki. Prisotnost benzena v vodi (do 5 mg/dm3) ne spremeni procesov biološke porabe kisika, saj benzen pod vplivom biokemičnih procesov v vodi slabo oksidira. V koncentracijah 5-25 mg/dm3 benzen ne zadržuje mineralizacije organskih snovi in ne vpliva na procese bakterijskega samočiščenja vodnih teles.
Benzen pri koncentraciji 1000 mg/dm3 zavira samočiščenje razredčene odpadne vode, pri koncentraciji 100 mg/dm3 pa zavira proces čiščenja odpadne vode v prezračevalnikih. Benzen pri vsebnosti 885 mg/dm3 močno zavira fermentacijo blata v digestorjih.
Pri ponavljajoči se izpostavljenosti nizkim koncentracijam benzena opazimo spremembe v krvi in hematopoetskih organih, poškodbe centralnega in perifernega živčnega sistema ter prebavil. Benzen je razvrščen kot zelo domnevno rakotvorna snov. Glavni metabolit benzena je fenol. Benzen ima toksičen učinek na vodne organizme.
FenoliFenoli so derivati benzena z eno ali več hidroksilnimi skupinami. Običajno jih delimo v dve skupini - fenole, ki so hlapni s paro (fenol, krezoli, ksilenoli, gvajakol, timol) in nehlapne fenole (rezorcinol, pirokatehol, hidrokinon, pirogalol in drugi polihidrični fenoli).
Fenoli v naravnih pogojih nastajajo v presnovnih procesih vodnih organizmov, med biokemijsko razgradnjo in pretvorbo organskih snovi, ki se pojavljajo tako v vodnem stolpcu kot v pridnenih usedlinah.
Fenoli so eno najpogostejših onesnaževal, ki vstopajo v površinske vode z odpadno vodo iz rafiniranja nafte, predelave skrilavca, lesno-kemične industrije, koksa, industrije anilinskih barv itd. V odpadni vodi teh podjetij lahko vsebnost fenolov preseže 10-20 g/ dm3 v zelo raznolikih kombinacijah.
V površinskih vodah so fenoli lahko raztopljeni v obliki fenolatov, fenolatnih ionov in prostih fenolov. Fenoli v vodah lahko vstopijo v reakcije kondenzacije in polimerizacije, pri čemer tvorijo kompleksne humusne in druge dokaj stabilne spojine. V pogojih naravnih rezervoarjev imajo procesi adsorpcije fenolov s sedimenti dna in suspendiranimi snovmi manjšo vlogo.
Preseganje naravne ravni ozadja fenola lahko kaže na onesnaženje vodnih teles. V naravnih vodah, onesnaženih s fenoli, lahko njihova vsebnost doseže desetine in celo stotine mikrogramov na 1 dm3. Fenoli so nestabilne spojine in so podvrženi biokemični in kemični oksidaciji.
Enostavni fenoli so dovzetni predvsem za biokemično oksidacijo. Pri koncentraciji nad 1 mg/dm3 pride do razgradnje fenolov precej hitro, izguba fenolov je 50-75 % v treh dneh, pri koncentraciji več deset mikrogramov na 1 dm3 se ta proces upočasni in izguba v istem času je 10-15%. Sam fenol se najhitreje razgradi, krezoli najpočasneje, ksilenoli pa še počasneje. Polihidrični fenoli se uničijo predvsem s kemično oksidacijo.
Koncentracija fenolov v površinskih vodah je podvržena sezonskim spremembam. Poleti se vsebnost fenolov zmanjša (z naraščanjem temperature se stopnja razgradnje poveča).
Izpuščanje fenolnih voda v rezervoarje in vodotoke močno poslabša njihovo splošno higiensko stanje, ki vpliva na žive organizme ne le s svojo strupenostjo, temveč tudi s pomembno spremembo režima hranil in raztopljenih plinov (kisika, ogljikovega dioksida).
Pri kloriranju vode, ki vsebuje fenole, nastanejo stabilne spojine klorofenolov, katerih najmanjše sledi (0,1 μg/dm3) dajejo vodi značilen okus.
V toksikološkem in organoleptičnem smislu so fenoli neenaki. Fenoli, hlapljivi s paro, so bolj strupeni in imajo intenzivnejši vonj, če so klorirani. Najbolj ostre vonjave proizvajajo preprosti fenoli in krezoli.
hidrokinonHidrokinon vstopa v površinske vode z odpadno vodo iz proizvodnje plastike, filmskih in fotografskih materialov, barvil in podjetij za rafiniranje nafte.
Hidrokinon je močno redukcijsko sredstvo. Tako kot fenol ima šibek dezinfekcijski učinek. Hidrokinon vodi ne daje vonja, okus se pojavi pri koncentraciji nekaj gramov na 1 dm3; mejna koncentracija za barvo vode je 0,2 mg / dm3, za vpliv na sanitarni režim vodnih teles - 0,1 mg / dm3. Hidrokinon pri vsebnosti 100 mg/dm3 vodo sterilizira, pri 10 mg/dm3 pa zavira razvoj saprofitne mikroflore. Pri koncentracijah pod 10 mg/dm3 hidrokinon oksidira in spodbuja razvoj vodnih bakterij. V koncentraciji 2 mg/dm3 hidrokinon zavira nitrifikacijo razredčene odpadne vode, 15 mg/dm3 - proces njihove biološke obdelave. Daphnije poginejo pri 0,3 mg/dm3; 0,04 mg/dm3 povzroči pogin iker postrvi.
V telesu se hidrokinon oksidira v p-benzokinon, ki pretvori hemoglobin v methemoglobin.
Alkoholi MetanolMetanol konča v vodnih telesih z odpadno vodo iz industrije za proizvodnjo in uporabo metanola. Odpadna voda iz podjetij celulozne in papirne industrije vsebuje 4,5-58 g / dm3 metanola, proizvodnja fenol-formaldehidne smole - 20-25 g / dm3, laki in barve 2 g / dm3, sintetična vlakna in plastika - do 600 mg / dm3, v odpadni vodi iz proizvodnih postaj, ki delujejo na rjavi premog, premog, šoto, les - do 5 g / dm3.
Ko metanol vstopi v vodo, zmanjša vsebnost O2 v njej (zaradi oksidacije metanola). Koncentracije nad 4 mg/dm3 vplivajo na sanitarni režim vodnih teles. Pri vsebnosti 200 mg/dm3 opazimo zaviranje biološkega čiščenja odpadne vode. Mejna vrednost vonja za metanol je 30-50 mg/dm3.
Koncentracija 3 mg/dm3 spodbuja rast modrozelenih alg in moti porabo kisika vodne bolhe. Letalne koncentracije za ribe so 0,25-17 g/dm3.
Metanol je močan strup, ki ciljno deluje na živčni in kardiovaskularni sistem, vidne živce in mrežnico. Mehanizem delovanja metanola je povezan z njegovo presnovo glede na vrsto smrtonosne sinteze s tvorbo formaldehida in mravljinčne kisline, ki se nato oksidirata v CO2. Okvara vida je posledica zmanjšanja sinteze ATP v mrežnici.
Etilen glikolEtilenglikol pride v površinske vode z odpadno vodo iz industrij, kjer se proizvaja ali uporablja (tekstilna, farmacevtska, parfumska, tobačna, celulozna in papirna industrija).
Strupena koncentracija za ribe ni večja od 10 mg / dm3, za E. coli - 0,25 mg / dm3.
Etilen glikol je zelo strupen. Pri zaužitju deluje predvsem na osrednje živčevje in ledvice, povzroča pa tudi hemolizo rdečih krvničk. Toksični so tudi presnovki etilenglikola - aldehidi in oksalna kislina, ki povzročata nastanek in kopičenje kalcijevih oksalatov v ledvicah.
Organske kislineOrganske kisline so med najpogostejšimi sestavinami naravnih voda različnega izvora in pogosto predstavljajo pomemben del celotne organske snovi v teh vodah. Sestavo organskih kislin in njihovo koncentracijo na eni strani določajo procesi znotraj rezervoarja, povezani z vitalno aktivnostjo alg, bakterij in živalskih organizmov, na drugi strani pa dobava teh snovi od zunaj.
Organske kisline nastanejo zaradi naslednjih procesov znotraj rezervoarja:
intravitalni izločki kot posledica normalnih fizioloških procesov zdravih celic;
posmrtni izcedek, povezan s celično smrtjo in razpadom;
izločki skupnosti, povezani z biokemičnim medsebojnim delovanjem različnih organizmov, kot so alge in bakterije;
encimska razgradnja organskih snovi z visoko molekulsko maso, kot so ogljikovodiki, beljakovine in lipidi.
Vnos organskih kislin v vodna telesa od zunaj je možen s površinskim odtokom, zlasti ob visokih vodah in poplavah, s padavinami, industrijskimi in gospodinjskimi odpadnimi vodami ter z vodo, ki se izpušča z namakanih polj.
Hlapne kislineHlapne kisline pomenijo vsoto koncentracij mravljinčne in ocetne kisline.
Mravljinčna kislina
V naravnih vodah mravljinčna kislina nastaja v majhnih količinah med procesi življenjskega delovanja in postmortalne razgradnje vodnih organizmov ter biokemične transformacije organskih snovi v vodi. Njegova povečana koncentracija je povezana z vstopom v vodna telesa odpadne vode podjetij, ki proizvajajo formaldehid in plastiko na njegovi osnovi.
Mravljinčna kislina migrira predvsem v raztopljenem stanju, v obliki ionov in nedisociiranih molekul, kvantitativno razmerje med katerimi določajo disociacijska konstanta K25°C = 2,4,10-4 in pH vrednosti. Ko mravljinčna kislina vstopi v vodna telesa, se uniči predvsem pod vplivom biokemičnih procesov.
Ocetna kislina Propionska kislinaPropionska kislina lahko pride v naravne vode z odpadno vodo iz kemične industrije.
Propionska kislina lahko poslabša organoleptične lastnosti vode, ji daje vonj in kiselkast okus. Najpomembnejši učinek propionske kisline je na sanitarni režim vodnih teles in predvsem na procese BPK in kisikovega režima. Popolna biokemijska oksidacija 1 mg propionske kisline zahteva 1,21 -1,25 mg molekularnega kisika.
Maslena kislina Mlečna kislinaV naravnih vodah je mlečna kislina prisotna v mikrogramskih koncentracijah kot posledica nastajanja v vitalnih procesih in posmrtni razgradnji vodnih organizmov ter biokemične transformacije organskih snovi v vodi.
Mlečna kislina se v vodi nahaja pretežno v raztopljenem stanju v obliki ionov in nedisociiranih molekul, količinsko razmerje med katerimi je določeno z disociacijsko konstanto K25°C = 3,10-4 in je odvisno od pH medija. Mlečna kislina delno migrira v obliki kompleksnih spojin s težkimi kovinami.
Koncentracija mlečne kisline je podvržena opaznim sezonskim spremembam, ki jih določa predvsem intenzivnost biokemičnih procesov, ki potekajo v vodi.
Benzojska kislinaV neonesnaženih naravnih vodah benzojska kislina nastaja v majhnih količinah med življenjskimi procesi vodnih organizmov in njihovim postmortalnim razkrojem. Glavni vir velikih količin benzojske kisline, ki vstopa v vodna telesa, je odpadna voda iz industrijskih podjetij, saj se benzojska kislina in njeni različni derivati pogosto uporabljajo pri konzerviranju hrane, v industriji parfumov, za sintezo barvil itd.
Benzojska kislina je zelo topna v vodi, njena vsebnost v površinskih vodah pa bo določena s koncentracijo izpuščene odpadne vode in hitrostjo biokemične oksidacije.
Benzojska kislina praktično nima strupenih lastnosti. Njegov neugoden učinek na rezervoar je povezan s spremembami kisikovega režima in pH vode.
Huminske kislineHuminske in fulvinske kisline, s skupnim imenom huminske kisline, pogosto sestavljajo znaten delež organske snovi naravnih voda in so kompleksne mešanice biokemično stabilnih visokomolekularnih spojin.
Glavni vir huminskih kislin, ki vstopajo v naravne vode, so prst in šotišča, iz katerih jih izpirajo deževnice in močvirne vode. Pomemben del huminskih kislin se vnese v vodna telesa skupaj s prahom in nastane neposredno v vodnem telesu med pretvorbo "žive organske snovi".
Huminske kisline v površinskih vodah so v raztopljenem, suspendiranem in koloidnem stanju, razmerja med katerimi določajo kemična sestava vode, pH, biološka situacija v rezervoarju in drugi dejavniki.
Prisotnost karboksilnih in fenolhidroksilnih skupin ter amino skupin v strukturi fulvičnih in huminskih kislin prispeva k nastanku močnih kompleksnih spojin huminskih kislin s kovinami. Nekatere huminske kisline so v obliki rahlo disociiranih soli – humatov in fulvatov. V kislih vodah je možen obstoj prostih oblik huminskih in fulvo kislin.
Huminske kisline pomembno vplivajo na organoleptične lastnosti vode, ustvarjajo neprijeten okus in vonj, otežujejo dezinfekcijo in pridobivanje posebej čiste vode ter pospešujejo korozijo kovin. Vplivajo tudi na stanje in stabilnost karbonatnega sistema, ionska in fazna ravnovesja ter razporeditev selitvenih oblik mikroelementov. Povečana vsebnost huminskih kislin lahko negativno vpliva na razvoj vodnih rastlinskih in živalskih organizmov zaradi močnega zmanjšanja koncentracije raztopljenega kisika v rezervoarju, kar vodi v njihovo oksidacijo, in njihovega uničujočega vpliva na stabilnost. vitaminov. Hkrati pri razgradnji huminskih kislin nastanejo znatne količine produktov, dragocenih za vodne organizme, njihovi organomineralni kompleksi pa predstavljajo najlažje prebavljivo obliko prehrane rastlin z mikroelementi.
Talne kisline: pri migraciji težkih kovin imajo največjo vlogo huminske kisline (v alkalnem okolju) in predvsem dobro topne fulvične kisline.
Huminske kisline
Huminske kisline vsebujejo ciklične strukture in različne funkcionalne skupine (hidroksilne, karbonilne, karboksilne, amino skupine itd.). Njihova molekulska masa se spreminja v širokem razponu (od 500 do 200.000 ali več). Relativna molekulska masa je običajno 1300-1500.
Fulvinske kislineFulvinske kisline so del huminskih kislin, ki se ne oborijo med nevtralizacijo organskih snovi, ekstrahiranih iz šote in rjavega premoga z obdelavo z alkalijami iz raztopine. Fulvinske kisline so spojine tipa hidroksikarboksilnih kislin z nižjo relativno vsebnostjo ogljika in izrazitejšimi kislimi lastnostmi.
Organski dušikZ "organskim dušikom" mislimo na dušik, ki je del organskih snovi, kot so beljakovine in proteini, polipeptidi (spojine z visoko molekulsko maso), aminokisline, amini, amidi, sečnina (spojine z nizko molekulsko maso).
Pomemben del organskih spojin, ki vsebujejo dušik, pride v naravne vode med odmiranjem organizmov, predvsem fitoplanktona, in razpadanjem njihovih celic. Koncentracijo teh spojin določata biomasa vodnih organizmov in hitrost teh procesov. Drug pomemben vir organskih snovi, ki vsebujejo dušik, je njihovo intravitalno sproščanje vodnih organizmov. Med pomembnimi viri dušikovih spojin so tudi atmosferske padavine, v katerih je koncentracija dušikovih organskih snovi blizu koncentracije v površinskih vodah. Znatno povečanje koncentracije teh spojin je pogosto povezano z vstopom industrijske, kmetijske in gospodinjske odpadne vode v vodna telesa.
UreaSečnina (urea), ki je eden od pomembnih odpadnih produktov vodnih organizmov, je v naravnih vodah prisotna v opaznih koncentracijah: do 10-50% količine dušikovih organskih spojin glede na dušik. Znatne količine sečnine vstopijo v vodna telesa z gospodinjskimi odpadnimi vodami, zbiralnimi vodami, pa tudi s površinskimi odtoki na območjih, kjer se uporabljajo kot dušikovo gnojilo. Sečnina se lahko kopiči v naravnih vodah kot posledica naravnih biokemičnih procesov kot presnovni produkt vodnih organizmov ali pa jo proizvajajo rastline, glive in bakterije kot produkt vezave amoniaka, ki nastane pri disimilaciji beljakovin. Ekstraorganizmski encimski procesi pomembno vplivajo na koncentracijo sečnine. Pod delovanjem encimov se mononukleotidi odmrlih organizmov razgradijo s tvorbo purinskih in pirimidinskih baz, te pa z mikrobiološkimi procesi razpadejo na sečnino in amoniak. Pod delovanjem specifičnega encima (ureaze) sečnina razpade na amonijev ion in jo zaužijejo organizmi vodnih rastlin.
Povečanje koncentracije sečnine lahko kaže na onesnaženje vodnega telesa s kmetijsko in gospodinjsko odpadno vodo. Običajno ga spremlja intenziviranje procesov uporabe sečnine s strani vodnih organizmov in poraba kisika, kar vodi do poslabšanja kisikovega režima.
aminiGlavni viri nastanka in vstopa aminov v naravne vode so:
dekarboksilacija med razgradnjo beljakovinskih snovi pod vplivom bakterijskih in glivičnih dekarboksilaz in aminacije;
morske alge;
padavine;
odpadne vode iz obratov za barvanje anilina.
Amini so prisotni pretežno v raztopljenem in deloma v sorbiranem stanju. Z nekaterimi kovinami lahko tvorijo dokaj stabilne kompleksne spojine.
Amini so strupeni. Splošno sprejeto je, da so primarni alifatski amini bolj toksični od sekundarnih in terciarnih aminov, diamini so bolj toksični od monoaminov; izomerni alifatski amini so bolj strupeni kot alifatski amini normalne strukture; monoamini so bolj verjetno hepatotoksični, diamini pa bolj verjetno nefrotoksični. Med alifatskimi amini so za nenasičene amine značilna največja toksičnost in potencialna nevarnost zaradi njihove najizrazitejše sposobnosti zaviranja aktivnosti aminoksidaz.
Amini, ki so prisotni v vodnih telesih, negativno vplivajo na organoleptične lastnosti vode in lahko poslabšajo pojave smrti.
AnilinAnilin je aromatski amin in je brezbarvna tekočina z značilnim vonjem.
Anilin lahko vstopi v površinske vode z odpadno vodo iz kemičnih (barvil in pesticidov) in farmacevtskih obratov.
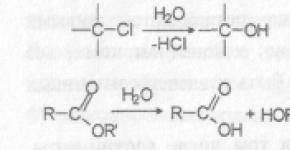
Anilin ima sposobnost oksidacije hemoglobina v methemoglobin. Heksametilentetramin - (CH2)6N4 Nitrobenzen je brezbarvna ali zelenkasto rumena oljnata tekočina z vonjem po grenkih mandljih. Nitrobenzen je strupen, prodira skozi kožo, močno vpliva na centralni živčni sistem, moti metabolizem, povzroča bolezni jeter in oksidira hemoglobin v methemoglobin. Metilmerkaptan je presnovni produkt živih celic. Prihaja tudi z odpadno vodo iz podjetij celulozne industrije (0,05 - 0,08 mg/dm3). V vodni raztopini je metil merkaptan šibka kislina in delno disociira (stopnja disociacije je odvisna od pH medija). Pri pH 10,5 je 50 % metil merkaptana v ionski obliki, pri pH 13 pride do popolne disociacije. Metil merkaptan je stabilen manj kot 12 ur in tvori soli – merkaptide. Dimetil sulfid sproščajo alge (Oedogonium, Ulothrix) med normalnimi fiziološkimi procesi, ki so bistveni v ciklu žvepla. Dimetil sulfid lahko pride tudi v površinske vode z odpadno vodo podjetij celulozne industrije (0,05 - 0,08 mg/dm3). Dimetil sulfida ni mogoče dolgo hraniti v vodi (stabilen od 3 do 15 dni). Delno se transformira s sodelovanjem alg in mikroorganizmov, večinoma pa izhlapi v zrak. V koncentracijah 1-10 μg/dm3 ima dimetil sulfid šibko mutageno delovanje. Dimetil disulfid nastaja v celicah različnih predstavnikov flore in favne med presnovo organožveplovih spojin in se lahko dovaja tudi z odpadno vodo podjetij celulozne industrije. Karbonilne spojine vključujejo spojine, ki vsebujejo karbonilne in karboksilne skupine (aldehidi, ketoni, ketokisline, polfunkcionalne snovi, ki vsebujejo karbonil). V naravnih vodah lahko karbonilne spojine nastanejo kot posledica intravitalnega izločanja alg, biokemične in fotokemične oksidacije alkoholov in organskih kislin, razgradnje organskih snovi, kot je lignin, in metabolizma bakteriobentosa. Stalna prisotnost karbonilnih spojin med kisikovimi spojinami nafte in v vodi v stiku z nahajališči ogljikovodikov nam omogoča, da slednje obravnavamo kot enega od virov obogatitve naravnih voda s temi snovmi. Kopenske rastline so tudi vir karbonilnih spojin, v katerih nastajajo aldehidi in ketoni alifatske serije ter derivati furana. Precejšen del aldehidov in ketonov pride v naravne vode zaradi človekove dejavnosti. Glavni dejavniki, ki povzročajo zmanjšanje koncentracije karbonilnih spojin, so njihova sposobnost oksidacije, hlapnost in relativno visoka trofična vrednost nekaterih skupin snovi, ki vsebujejo karbonil. Aceton pride v naravne vode z odpadno vodo iz farmacevtske, lesno-kemijske industrije, proizvodnje lakov in barv, plastike, filma, acetilena, acetaldehida, ocetne kisline, pleksi stekla, fenola, acetona. Pri koncentracijah 40-70 mg/dm3 daje aceton vodi vonj, 80 mg/dm3 pa okus. V vodi aceton ni obstojen – pri koncentracijah 20 mg/dm3 izgine sedmi dan. Aceton je relativno nizko strupen za vodne organizme. Strupene koncentracije za mlade bolhe so 8300, za odrasle - 12900 mg / dm3; pri 9300 mg/dm3 bolhe poginejo po 16 urah. Aceton je zdravilo, ki vpliva na vse dele centralnega živčnega sistema. Poleg tega ima embriotoksični učinek. Formaldehid pride v vodno okolje z industrijsko in komunalno odpadno vodo. Najdemo ga v odpadnih vodah iz proizvodnje osnovne organske sinteze, plastike, lakov, barv, zdravil, usnjarske, tekstilne in celulozno-papirne industrije. Prisotnost formaldehida je bila zabeležena v deževnici v urbanih območjih. Formaldehid je močno redukcijsko sredstvo. Kondenzira z amini in tvori metenamin z amoniakom. V vodnem okolju je formaldehid podvržen biorazgradnji. V aerobnih pogojih pri 20 °C traja razgradnja približno 30 ur, v anaerobnih pogojih - približno 48 ur. Formaldehid se v sterilni vodi ne razgradi. Biorazgradnjo v vodnem okolju povzroča delovanje Pseudomonas, Flavobacterium, Mycobacterium, Zanthomonas. Podpražna koncentracija, ki ne vpliva na sanitarni režim vodnih teles in saprofitne mikroflore, je 5 mg/dm3; najvišja koncentracija, ki ne povzroči motenj biokemičnih procesov pri stalni izpostavljenosti poljubno dolgo časa, je 5 mg/dm3, najvišja koncentracija, ki ne vpliva na delovanje bioloških čistilnih naprav, je 1000 mg/dm3. BPK5 = 0,68 mg/dm3, BPKskupaj = 0,72 mg/dm3, KPK = 1,07 mg/dm3. Vonj je čutiti pri 20 mg/dm3. Pri 10 mg/dm3 ima formaldehid toksičen učinek na najbolj občutljive vrste rib. Pri 0,24 mg/dm3 dobijo ribja tkiva neprijeten vonj. Formaldehid ima splošen toksičen učinek, ki povzroča poškodbe centralnega živčnega sistema, pljuč, jeter, ledvic in organov vida. Možen učinek na resorpcijo kože. Formaldehid deluje dražilno, alergeno, mutageno, senzibilizirajoče in rakotvorno. Ogljikovi hidrati so skupina organskih spojin, ki vključuje monosaharide, njihove derivate in produkte kondenzacije - oligosaharide in polisaharide. Ogljikovi hidrati vstopajo v površinske vode predvsem kot posledica procesov intravitalnega sproščanja vodnih organizmov in njihove postmortalne razgradnje. Znatne količine raztopljenih ogljikovih hidratov vstopijo v vodna telesa s površinskim odtokom zaradi izpiranja iz tal, šotnih barij, kamnin, s padavinami in z odpadno vodo iz tovarn kvasa, pivovarstva, sladkorja, celuloze in papirja ter drugih. V površinskih vodah so ogljikovi hidrati raztopljeni in suspendirani v obliki prostih reducirajočih sladkorjev (mešanica mono-, di- in trisaharidov) in kompleksnih ogljikovih hidratov. Literatura: "Hidrokemijski indikatorji stanja okolja." Avtorji: T. V. Guseva, Y. P. Molchanova, E. A. Zaika, V. N. Vinichenko, E. M. Averochkin Glede na primarno produkcijo jih delimo na oligotrofne (nizko produktivne), mezotrofne (srednje produktivne), evtrofne (visoko produktivne) in hiperevtrofne (preveč produktivne). 3. Saprobnost vodnih teles Stopnjo onesnaženosti vodnih teles z organskimi snovmi določa njihova saprobnost (sapros-razpad), veja hidroekologije, ki proučuje tovrstno onesnaženje, pa je saprobiologija. Vodni organizmi... Nafta, proučevana na različnih ravneh - od splošnih fizikalnih in kemijskih lastnosti do molekularnih reakcij - je bila osnova za razvito metodologijo za proučevanje organske snovi z nafto onesnaženih geosistemov in je bila uporabljena za identifikacijo virov onesnaženja z ogljikovodiki v vodnem zajetju Usolka. Prisotnost naftnih derivatov v sestavi akvabitumoidov v površinskih in podzemnih vodah vodnega zajetja... NACIONALNA UNIVERZA DONETSK FAKULTETA ZA KEMIJO ODSEK ZA ORGANSKO KEMIJO Uvod…………………………………………………………...3 Pregled literature. Razvrstitev in lastnosti odpadna voda………………………………………………………………..……5 Fizikalno stanje odpadne vode……………………….....….8 Sestava odpadne vode………………………………………………………...10 Bakterijska kontaminacija odpadne vode…………………...11 Zadrževalnik kot sprejemnik odpadne vode……………………………..11 Metode čiščenja EPS…………………………………………………………12 Mehansko čiščenje EPS……………………………………..13 Fizikalno-kemijsko čiščenje EPS……………………………14 Kemijska analiza PSV………………………………………..16 Določanje organskih snovi s kromatografijo…………………………….………..18 Določanje organskih spojin z masno spektrometrijo………………………….……….19 Kemijske testne metode analize……………………………….20 Praktični del. Metoda plinske kromatografije……………………………..24 Metoda masne spektroskopije……………………………………..26 Sklepi………………………………………………………………………...27 Literatura…………………………………..28 Uvod
Voda je najdragocenejši naravni vir. Ima izjemno vlogo v presnovnih procesih, ki so osnova življenja. Voda ima velik pomen v industrijski in kmetijski proizvodnji. Znano je, da je nujen za vsakdanje potrebe ljudi, vseh rastlin in živali. Služi kot življenjski prostor številnim živim bitjem. Rast mest, hiter razvoj industrije, intenzifikacija kmetijstva, znatno povečanje namakanih površin, izboljšanje kulturnih in življenjskih razmer ter številni drugi dejavniki vse bolj zapletajo probleme oskrbe z vodo. Povpraševanje po vodi je ogromno in vsako leto narašča. Letna poraba vode na svetu za vse vrste oskrbe z vodo je 3300-3500 km3. Poleg tega se 70 % vse porabe vode porabi v kmetijstvu. Kemična in celulozno-papirna industrija, črna in barvna metalurgija porabijo veliko vode. Razvoj energetike vodi tudi v močno povečanje povpraševanja po vodi. Znatna količina vode se porabi za potrebe živinoreje, pa tudi za gospodinjske potrebe prebivalstva. Večina vode se po porabi za gospodinjske potrebe vrne v reke v obliki odpadne vode. Pomanjkanje sladke vode že postaja svetovni problem. Vedno večje potrebe industrije in kmetijstva po vodi silijo vse države in znanstvenike po vsem svetu, da iščejo različne načine za rešitev tega problema. V sedanji fazi se določajo naslednje usmeritve racionalne rabe vodnih virov: popolnejša raba in razširjena reprodukcija sladkovodnih virov; razvoj novih tehnoloških procesov za preprečevanje onesnaževanja vodnih teles in zmanjšanje porabe sveže vode. Hiter razvoj industrije ustvarja potrebo po preprečevanju negativnega vpliva industrijskih odpadnih voda (IWW) na vodna telesa. Zaradi izjemne raznolikosti sestave, lastnosti in pretočnosti odpadne vode iz industrijskih podjetij je potrebna uporaba posebnih metod ter naprav za lokalno, predhodno in popolno čiščenje teh voda. Ena od glavnih smeri znanstvenega in tehnološkega napredka je ustvarjanje tehnoloških procesov z nizkimi odpadki in brez odpadkov. Namen dela je seznanitev z literaturo o metodah čiščenja odpadnih voda. Pregled literature
Mineralni onesnaževalci vključujejo: pesek; delci gline; delci rude in žlindre; soli, kisline, alkalije in druge snovi, raztopljene v vodi. Organski onesnaževalci so rastlinskega in živalskega izvora. Na zelenjavo vključujejo ostanke rastlin, sadja, zelenjave in žit, papir, rastlinska olja, huminske snovi in drugo. Glavni kemični element, vključen v ta onesnaževala, je ogljik. Do onesnaženja živalskega izvora vključujejo fiziološke izločke živali in ljudi, ostanke mišičnih in maščobnih tkiv živali, organske kisline in drugo. Glavni kemični element teh onesnaževal je dušik. Domača voda vsebuje približno 60 % organskih onesnaževal in 40 % mineralnih onesnaževal. V PSV so lahko ta razmerja drugačna in se razlikujejo glede na vrsto surovin, ki se obdelujejo, in proizvodni proces. Do bakterijske kontaminacije vključujejo žive mikroorganizme - kvasovke in plesni ter različne bakterije. Gospodinjska odpadna voda vsebuje takšne patogene bakterije (patogene) - povzročitelje tifusa, paratifusa, dizenterije, antraksa itd., Pa tudi jajca helmintov (črvi), ki vstopajo v odpadno vodo z izločki ljudi in živali. Patogene vsebujejo tudi nekateri PSV. Na primer v odpadni vodi iz usnjarn, tovarn za primarno predelavo volne itd. Glede na izvor, sestavo in kakovostne značilnosti onesnaževalcev (nečistoč) delimo odpadno vodo v 3 glavne kategorije: gospodinjsko (gospodinjsko in fekalno), industrijsko (industrijsko) in atmosfersko. 1.2 Agregatno stanje odpadne vode
Neraztopljena oblika; Koloidni videz; Raztopljen pogled. Neraztopljeno snovi najdemo v odpadni vodi v obliki grobe suspenzije z velikostjo delcev nad 100 mikronov in v obliki fine suspenzije (emulzije) z velikostjo delcev od 100 do 0,1 mikrona. Študije kažejo, da v gospodinjskih odpadnih vodah ostaja količina neraztopljenih suspendiranih trdnih snovi bolj ali manj konstantna in znaša 65 g/dan na osebo, ki uporablja kanalizacijo; od tega se lahko 40g obori pri usedanju. Koloidni snovi v vodi imajo velikost delcev od 0,1 do 0,001 mikrona. Na sestavo koloidne faze gospodinjske odpadne vode vplivajo njene organske sestavine - beljakovine, maščobe in ogljikovi hidrati, pa tudi produkti njihove fiziološke predelave. Velik vpliv ima tudi kakovost vode iz pipe, ki vsebuje različne količine karbonatov, sulfatov in železa. Odpadna voda poleg dušika in ogljika vsebuje tudi velike količine žvepla, fosforja, kalija, natrija, klora in železa. Ti kemični elementi so del organskih ali mineralnih snovi, ki jih najdemo v odpadni vodi v neraztopljenem, koloidnem ali raztopljenem stanju. Količina teh snovi, vnesenih z onesnaževalci v odpadno vodo, se lahko spreminja in je odvisna od narave tvorbe. Pri gospodinjskih odpadnih vodah pa ostaja količina vnesenih kemikalij na osebo bolj ali manj konstantna. Torej, na osebo na dan pride (g): Koncentracija teh snovi v odpadni vodi (mg/l) se spreminja glede na stopnjo redčenja onesnaževalcev z vodo: večja kot je stopnja odstranjevanja vode, nižja je koncentracija. Vsebnost železa in sulfatov v odpadni vodi je odvisna predvsem od njihove prisotnosti v vodovodni vodi. Količina naštetih, kot tudi drugih sestavin, ki vstopajo v EPS s kontaminanti, je zelo različna in ni odvisna le od njihove vsebnosti v razredčeni vodi iz pipe in predelanem produktu, temveč tudi od proizvodnega procesa, režima vode, ki vstopa v proizvodnjo, omrežje in drugi razlogi. Posledično je za to vrsto proizvodnje mogoče ugotoviti le okvirno količino onesnaževal, ki jih vsebuje izpuščeni EPS. Pri načrtovanju industrijske kanalizacije so potrebni podatki iz analize PSV, le če teh podatkov ni mogoče pridobiti, lahko uporabite podatke iz podobnih industrij. Sestava in količina PSV sta različni. Tudi podjetja iste vrste, kot so strojarne, lahko glede na naravo tehnološkega procesa odvajajo odpadne vode različnih sestav in v različnih količinah. Nekateri EPS ne vsebujejo več onesnaževalcev kot gospodinjski odpadki, drugi pa jih vsebujejo veliko več. Tako voda iz tovarn za predelavo rude vsebuje do 25.000 mg/l suspendiranih delcev, iz pralnic volne pa do 20.000 mg/l. EPS delimo na pogojno čiste in onesnažene. Pogojno čiste vode so pogosto tiste, ki so bile uporabljene za hlajenje; se skoraj ne spreminjajo, ampak samo segrejejo. Onesnažene industrijske vode delimo v skupine, ki vsebujejo določene onesnaževalce: a) pretežno mineralne; b) pretežno organski, mineralni; c) organske, strupene snovi. Glede na koncentracijo kontaminantov je EPS lahko visoko koncentriran ali šibko koncentriran. Glede na aktivno reakcijo vode se industrijske vode glede na stopnjo agresivnosti delijo na nizko agresivne vode (šibko kisle s pH = 6 - 6,6 in rahlo alkalne s pH = 8 - 9) in visoko agresivne (s pH 9). ). Floro in favno odpadne vode predstavljajo bakterije, virusi, bakteriofagi, helminti in glive. Odpadna tekočina vsebuje ogromno bakterij: v 1 ml odpadne vode jih je lahko do 1 milijarde. Večina teh bakterij spada v kategorijo neškodljivih bakterij (saprofitske bakterije), ki se razmnožujejo na mrtvem organskem okolju, obstajajo pa tudi takšne, ki se razmnožujejo in živijo na živih snoveh (patogene bakterije), ki uničujejo živ organizem v procesu njihovega vitalnega delovanja. dejavnost. Patogeni mikroorganizmi, ki jih najdemo v komunalni odpadni vodi, vključujejo tifus, paratifus, dizenterijo, vodno mrzlico, tularemijo itd. Prisotnost posebne vrste bakterij v njej - skupine E. coli - nakazuje, da je voda onesnažena s patogenimi bakterijami. Te bakterije niso patogene, vendar njihova prisotnost nakazuje, da so v vodi lahko patogene bakterije. Za oceno stopnje kontaminacije vode s patogenimi bakterijami se določi titer koli, tj. najmanjša količina vode na ml, ki vsebuje eno E. coli. Torej, če je titer E. coli 100, to pomeni, da 10 ml testirane vode vsebuje eno E. coli. Pri titru 0,1 je število bakterij v 1 ml 10 itd. Za komunalne odpadne vode titer E. coli običajno ne presega 0,000001. Včasih se določi indeks coli ali število E. coli v 1 litru vode. Večina sprejemnikov odpadne vode so zbiralniki. Odpadna voda mora biti pred izpustom v zbiralnik delno ali v celoti prečiščena. Vendar pa rezervoar vsebuje določeno količino kisika, ki se lahko delno uporabi za oksidacijo organskih snovi, ki vstopajo vanj skupaj z odpadno vodo; rezervoar ima določeno sposobnost čiščenja, tj. v njej lahko s pomočjo mikroorganizmov - mineralizatorjev oksidirajo organske snovi, vendar bo vsebnost raztopljenega kisika v vodi padla. Če veste to, lahko zmanjšate stopnjo čiščenja odpadne vode na čistilnih napravah, preden jo izpustite v zbiralnik. Ne bi smeli pretiravati o sposobnosti zbiralnikov, zlasti rek, da sprejmejo velike mase odpadne vode, tudi če ravnovesje kisika omogoča tak izpust brez končne obdelave. Vsako vodno telo, tudi majhno, se uporablja za množično kopanje in ima arhitekturni, dekorativni in sanitarni pomen. PSV so običajno razdeljeni v 3 glavne skupine: Za čiščenje EPS se uporabljajo naslednje metode: Napenjanje uporablja se za ločevanje velikih plavajočih snovi in manjših, predvsem vlaknastih onesnaževalcev iz odpadne tekočine. Za ločevanje velikih snovi se uporabljajo rešetke, manjše pa sita. Za vse čistilne naprave so obvezne rešetke za predčiščenje. Sita se uporabljajo kot samostojne naprave, po katerih se EPS lahko izpusti bodisi v rezervoar bodisi v mestno kanalizacijsko omrežje. Z obrambo izolirati neraztopljene in delno koloidne onesnaževalce mineralnega in organskega izvora iz EPS. Z usedanjem je mogoče iz odpadne vode ločiti tako delce s specifično težo, ki je večja od specifične teže vode (tonejo), kot delce z manjšo specifično težo (lebdijo). Usedalniki za čiščenje EPS so lahko samostojni objekti, kjer se proces čiščenja zaključi, ali objekti, namenjeni le predhodnemu čiščenju. Za ločevanje ponikajočih netopnih nečistoč se uporabljajo horizontalni in radialni usedalniki, njihova zasnova se malo razlikuje od usedalnikov, ki se uporabljajo za bistrenje gospodinjskih odpadnih voda. Filtracija služi za zadrževanje suspendiranih snovi, ki se med usedanjem niso usedle. Uporabljajo se peščeni filtri, diatomejski filtri in mrežasti filtri s filtrirno plastjo. Peščeni filtri uporablja se za nizko vsebnost suspendiranih trdnih snovi. Dvoslojni filtri so se dobro izkazali. Spodnja plast nakladanja je pesek z velikostjo zrn 1 - 2 mm, zgornja plast pa antracitni drobci. Odpadna voda se dovaja od zgoraj, nato se dovaja voda za izpiranje in odvaja umazana voda. Diatomitni filtri. V teh filtrih se odpadna tekočina filtrira skozi tanko plast diatomejske zemlje, naneseno na porozne površine. Kot porozni material se uporablja keramika, kovinska mreža in tkanina. Uporabljajo se tudi umetni praškasti sestavki iz diatomejske zemlje z visoko adsorpcijsko sposobnostjo. Takšni filtri zagotavljajo visok čistilni učinek. Hidrocikloni uporablja se za bistrenje odpadne vode in zgoščevanje blata. So odprti in pritiskajo. Odprti hidrocikloni se uporabljajo za ločevanje strukturnih usedlin in grobih lebdečih nečistoč iz odpadne vode. Tlačni hidrocikloni se uporabljajo za ločevanje samo usedlinskih, na agregate odpornih, grobih strukturnih nečistoč iz odpadne vode. Odprti hidrocikloni so na voljo brez notranjih naprav, z diafragmo in cilindrično predelno steno ter večstopenjski. Slednji se uporabljajo za ločevanje težkih grobih nečistoč, ki se ne strdijo, in naftnih derivatov. Fizikalno-kemijske metode čiščenja vključujejo: a) ekstrakcijo; b) sorpcija; c) kristalizacija; d) flotacija. A) Ekstrakcija. Bistvo ekstrakcijske metode čiščenja industrijskih odpadnih voda je naslednje. Pri mešanju medsebojno netopnih tekočin se onesnaževala v njih porazdelijo v teh tekočinah glede na njihovo topnost. Če odpadna voda vsebuje fenol, lahko za njegovo ločitev vodo zmešamo z benzenom (topilo), v katerem se fenol raztopi v veliko večji meri. Tako je z zaporedno obdelavo vode z benzenom mogoče doseči skoraj popolno odstranitev fenola iz vode. Kot topila se običajno uporabljajo različne organske snovi: benzen, ogljikov tetraklorid itd. Ekstrakcija se izvaja v kovinskih ekstrakcijskih rezervoarjih v obliki kolon s šobami. Od spodaj se dovaja topilo, katerega specifična teža je manjša od specifične teže vode, zaradi česar se topilo dvigne navzgor. Onesnažena odpadna voda se dovaja od zgoraj. Plasti vode, ki na svoji poti naletijo na topilo, postopoma sproščajo onesnaževala vode. Voda, očiščena onesnaževal, se odvaja od spodaj. Ta tehnika lahko zlasti očisti EPS, ki vsebuje fenol. B) Sorpcija. Ta proces je sestavljen iz dejstva, da onesnaževalce iz odpadne tekočine absorbira trdno telo (adsorpcija), odloži na njegovo aktivno razvito površino (adsorpcija) ali vstopi v kemično interakcijo z njim (kemisorpcija). Za čiščenje EPS se največkrat uporablja adsorpcija. V tem primeru se odpadni tekočini, ki jo je treba obdelati, doda zdrobljen sorbent (trdno telo) in pomeša z odpadno vodo. Nato se sorbent, nasičen s kontaminanti, loči od vode z usedanjem ali filtriranjem. Pogosteje se prečiščena odpadna voda neprekinjeno prenaša skozi filter, napolnjen s sorbentom. Uporabljajo se naslednji sorbenti: aktivno oglje, koksov sapnik, šota, kaolin, žagovina, pepel itd. Najboljša, a najdražja snov je aktivno oglje. Sorbcijsko metodo lahko uporabimo na primer za čiščenje EPS iz plinskih postaj, ki vsebujejo fenol, pa tudi EPS, ki vsebuje arzen, vodikov sulfid itd. c) Kristalizacija. To metodo čiščenja je mogoče uporabiti le, če obstaja znatna koncentracija onesnaževalcev v EPS in njihova sposobnost tvorbe kristalov. Običajno je predhodni postopek izhlapevanje odpadne vode, da se ustvari povečana koncentracija onesnaževal, pri kateri je možna kristalizacija. Da bi pospešili proces kristalizacije onesnaževal, odpadno vodo ohladimo in premešamo. Izhlapevanje in kristalizacija odpadne vode se običajno izvaja v naravnih ribnikih in rezervoarjih. Ta metoda čiščenja EPS je negospodarna in zato ni v široki uporabi. D) Flotacija. Postopek temelji na lebdenju razpršenih delcev skupaj z zračnimi mehurčki. Uspešno se uporablja v številnih vejah tehnike in za čiščenje EPS. Postopek flotacije vključuje molekule netopnih delcev, ki se prilepijo na zračne mehurčke in skupaj priplavajo na površino. Uspeh flotacije je v veliki meri odvisen od velikosti površine zračnih mehurčkov in površine njihovega stika s trdnimi delci. Za povečanje učinka flotacije se v vodo vnesejo reagenti. Glavne zahteve za metode analize odpadne vode so visoka selektivnost, sicer lahko pride do sistematičnih napak, ki popolnoma izkrivljajo rezultat študije. Občutljivost analize je manj pomembna, saj lahko vzamemo velike količine analizirane vode ali uporabimo ustrezno metodo koncentriranja določene komponente. Za koncentracijo določenih komponent v odpadni vodi se uporabljajo ekstrakcija, izhlapevanje, destilacija, sorpcija, koprecipitacija in zamrzovanje vode. Tabela 2. Sheme ločevanja komponent odpadne vode z visoko vsebnostjo hlapnih organskih snovi. Alkalizirajte in ponovno oddestilirajte s paro, dokler ne nastane majhen ostanek. Tabela 3. Shema ločevanja nizkohlapnih organskih komponent odpadne vode 1.6.3.1 Določitev organskih snovi s kromatografijo
Za identifikacijo in kvantifikacijo se široko uporabljajo različne kromatografske metode - plinska, kolonska, tekočinska kromatografija, papirna kromatografija, tankoplastna kromatografija. Za kvantitativno določanje je najprimernejša metoda plinske kromatografije. Kot primer razmislite o določanju fenolov. Te spojine nastajajo ali se uporabljajo v procesu rafiniranja nafte, proizvodnje papirja, barvil, zdravil, fotografskih materialov in sintetičnih smol. Zaradi fizikalnih in kemijskih lastnosti fenolov jih je relativno enostavno določiti s plinsko kromatografijo. Preostale količine oktilfenolpolietoksilatov v odpadnih vodah, produktov njihove biorazgradnje in kloriranja, ki nastanejo pri biološkem čiščenju in dezinfekciji odpadnih voda, lahko določimo z GLC-MS z EI ali kemično ionizacijo. Potreba po analizi spojin različne hlapnosti se odraža v shemi analize sledov organskih spojin v odpadni vodi po čiščenju na čistilni napravi. Tu je bil GLC uporabljen za kvantitativne določitve, kvalitativna analiza pa je bila izvedena z uporabo GC-MS. Zelo hlapne spojine – halogenirane ogljikovodike C1–C2 – ekstrahiramo s pentanom iz 50 ml vzorca vode; 5 μl ekstrakta smo vbrizgali v kolono 2mx 4 mm z 10 % skvalanom na Chromosorb W – AW pri temperaturi 67 °C; nosilni plin – mešanica argona in metana; detektor za zajem elektronov s 63 Ni. Če je bilo treba določiti metilenklorid, je bil pentan, ki se je eluiral z njim, zamenjan z oktanom, ki je eluiral kasneje. Kot interni standard smo uporabili 1,2-dibromoetan. Skupina aromatskih ogljikovodikov je bila določena z uporabo zaprte zanke. Kombinacija različnih ionizacijskih metod omogoča zanesljivejšo identifikacijo različnih sestavin onesnaženja odpadne vode. Kombinacija GC in MS z EI in CI ionizacijo se uporablja za splošno karakterizacijo organskih snovi, prisotnih v odpadni vodi in blatu iz čistilnih naprav. Organske spojine ekstrahirane iz odpadne vode s heksanom smo kromatografirali na silikagelu z eluiranjem s heksanom, metilen kloridom in etrom. Nastale frakcije smo analizirali na sistemu, ki ga sestavlja plinski kromatograf s 25 m dolgo kapilarno cevjo, povezano z ionskim virom masnega spektrometra z dvojnim fokusom. Temperaturo kolone smo programirali od 40 do 250 °C s hitrostjo 8 °C/min. Na podlagi plinsko kromatografskih retenzijskih časov ter masnih spektrov EI in CI je bilo identificiranih 66 spojin. Med temi spojinami so bili halogenirani metoksibenzeni, diklorobenzen, heksaklorobenzen, metilirani triklosan, oksadiazon itd. Ta metoda je omogočila tudi polkvantitativno oceno koncentracij teh spojin. Pri testni analizi se fenol in njegovi derivati pretežno določajo s tvorbo azo barvila. Najpogostejša metoda je naslednja: prva faza je diazotizacija primarnega aromatskega amina z natrijevim nitritom v kislem okolju, kar vodi do tvorbe diazonijeve soli: Spajanje azoze s hidroksi spojinami, najbolj aktivnimi v obliki fenolatnih anionov, se skoraj vedno izvaja pri pH 8 – 11. Diazonijeve soli V vodni raztopini so nestabilni in postopoma razpadejo na fenole in dušik, zato je glavna težava pri ustvarjanju testnih metod za določanje fenolov in aminov prav v pridobivanju stabilnih diazo spojin. Kompleksna sol 4-nitrofenildiazonijevega tetrafluoroborata (NDF) je bila predlagana kot skladiščno stabilen reagent za določanje fenola: V prisotnosti CP pride do poglobitve barve zaradi tvorbe ionskega asociata na disociirani hidroksi skupini: Večina testnih metod uporablja 4-aminoantipirin kot reagent. Fenol in njegovi homologi s 4-aminoantipirinom tvorijo obarvane spojine v prisotnosti heksacianoferata (III) pri pH 10: n-krezol in tisti para-substituirani fenoli, v katerih so substituentske skupine alkilne, benzoilne, nitro, nitrozo in aldehidne skupine, praktično ne reagirajo s 4-aminoantipirinom. Razpon določenih vsebnosti za sisteme NANOCOLOR ® Phenol, Hach Co., CHEMetrics je 0,1 – 5,0 mg/l fenola. 2. Praktični del
Ker je sestava EPS precej raznolika, je potrebno stalno spremljanje kakovosti čiščenja teh voda. Oglejmo si nekaj metod za določanje organskih spojin v naravni odpadni vodi. Analizirano odpadno vodo razredčimo z enakim volumnom 1 M raztopine natrijevega hidroksida, ekstrahiramo z mešanico dietil in petroletra v razmerju 1:1, da ločimo vse druge organske snovi, ki jih vsebuje odpadna voda, od natrijevih soli fenolov, ki ostanejo v vodni fazi. Vodno fazo ločimo, nakisamo in vnesemo v plinski kromatograf. Pogosteje pa fenole ekstrahiramo z benzenom in dobljeni benzenski ekstrakt kromatografiramo. Tako fenole kot njihove metilne estre je mogoče kromatografirati. Slika prikazuje plinski kromatogram benzenskega ekstrakta mešanice fenolov, pridobljen na stekleni koloni dolžine 180 cm z zunanjim premerom 6 mm, napolnjene s tekočo fazo ogljikovih hidratov tipa apiezon L. Kromatografijo smo izvedli pri temperatura kolone 170 °C, temperatura detektorja 290 °C in hitrost nosilnega plina 70 ml/min. Uporabljen je bil plamensko ionizacijski detektor. Pod temi pogoji je ločitev vrhov v kromatogramu dovolj jasna in je mogoče izvesti kvantitativno določitev O- In p-klorofenoli, fenol in m-krezol. Za določanje majhnih količin organskih spojin jih je potrebno predhodno koncentrirati s sorpcijo na aktivnem oglju. Odvisno od vsebnosti organskih spojin boste morda potrebovali od 10–20 g do 1,5 kg premoga. Po prehodu analizirane vode skozi posebej prečiščene snovi je potrebno desorbirati. Za to oglje posušimo na bakrenem ali steklenem pladnju v atmosferi čistega zraka, posušeno oglje damo v papirnato kartušo, prekrito s stekleno volno, in desorbiramo z ustreznim topilom v Soxhletovem aparatu 36 ur. ali več. Nobeno čisto topilo ne more ekstrahirati vseh sorbiranih organskih snovi, zato se je treba zateči k zaporedni obdelavi z več topili ali uporabiti mešanice topil. Najbolj zadovoljivo ekstrakcijo sorbiranih organskih snovi dosežemo z uporabo mešanice 47 % 1,2-dikloropropanola in 53 % metanola. Po ekstrakciji topilo oddestiliramo, ostanek raztopimo v kloroformu. Če ostane netopen ostanek, ga raztopimo v ocetni kislini, odparimo in suhi ostanek stehtamo. Raztopino kloroforma raztopimo v etru in nato izvedemo analizo, podano v tabeli. 3. Vzorec smo dali v ekstraktor, dodali interni standard, pokrili s filtrom z aktivnim ogljem in parno fazo 30 s prezračevali skozi filter, da smo iz zraka odstranili nečistoče. Po tem smo namestili čisti filter in nastavili pretok na 1,5 l/min. Po 2 urah smo filter odstranili in ekstrahirali s tremi 7 μL porcijami CS 2 ter analizirali s kapilarnim GLC s plamensko ionizacijskim detektorjem. Klorirane ogljikovodike, pesticide, poliklorirane bifenile, policiklične aromatske ogljikovodike ekstrahiramo z 2 × 15 ml heksana v 1 litru vzorca vode. Po vsaj 6-urnem usedanju smo faze ločili, ekstrakte posušili, koncentrirali na 1 ml v toku dušika in očistili na koloni Florisiome. Klorirane ogljikovodike, pesticide in bifenile smo eluirali s 70 ml mešanice heksana in etra (85:15) in koncentrirali na 1 ml. Koncentrat smo analizirali na 50 m dolgi stekleni kapilarni koloni s SE-54 z detektorjem za zajemanje elektronov, identifikacijo neznanih spojin smo izvedli z GC–MS. Klorirane parafinske ogljikovodike v odtoku blata, sedimentih in drugih okoljskih objektih smo določili tako, da smo vzorce obdelali z žveplovo kislino in jih z adsorpcijsko kromatografijo na Al 2 O 3 ločili na frakcije z minimalno kontaminacijo z drugimi spojinami. Te frakcije v raztopini heksana smo vbrizgali v 13 m × 0,30 mm SE-54 kromatografsko kolono. Začetna temperatura kolone je bila 60 °C; po 1 minuti je temperatura začela naraščati s hitrostjo 10 °C/min do 290 °C. Celotni masni spektri so bili posneti v masnem območju od 100 do 600 a.e. e.m. vsaki 2 s. Meja detekcije je bila 5 ng, kar je ustrezalo relativni koncentraciji 10 -9. S sistematičnimi analizami kakovosti prečiščene in rečne vode je leta 1903 začel laboratorij profesorja V. R. Williamsa na Kmetijski akademiji. V kemični industriji je predvideno širše uvajanje nizkoodpadnih in brezodpadnih tehnoloških procesov, ki zagotavljajo največji okoljski učinek. Veliko pozornosti namenjamo izboljšanju učinkovitosti čiščenja industrijskih odpadnih voda. Onesnaževanje vode, ki jo izpusti podjetje, je mogoče znatno zmanjšati z ločevanjem dragocenih nečistoč iz odpadne vode; kompleksnost reševanja teh problemov v podjetjih kemične industrije je v raznolikosti tehnoloških procesov in posledičnih izdelkov. Poudariti je treba tudi, da se večina vode v industriji porabi za hlajenje. Prehod z vodnega hlajenja na zračno bo zmanjšal porabo vode v različnih panogah za 70-90%. Bibliografija
M.: Kemija, 1984. 3. Novikov Yu V., Lastochkina K. O., Boldina Z. N. Metode študije kakovosti vode v rezervoarjih. 2. izdaja, revidiran in razširjen. M., "Medicina", 1990, 400 str. z ilustracije. 4. Yakovlev S.V., Laskov Yu.M. Kanalizacija. 5. izdaja, revidiran in razširjen. Učbenik za tehnične šole. M., Stroyizdat, 1972, 280 str. z ilustracijami. 5. Zolotov Yu A., Ivanov V. M., Amelin V. G. Kemični testi metode analize. – M.: Uvodnik URSS, 2002. – 304 str. 6. Masna spektrometrija onesnaženosti okolja / R. A. Hmelnicki, E. S. Brodinski. – M.: Kemija, 1990. – 184 str. 7. Morosanova S. A., Prokhorova G. V., Semenovskaya E. N. Metode za analizo naravnih in industrijskih objektov: Učbenik dodatek. – M.: Založba Mosk. Univ., 1988. 95 str.
1.1. Klasifikacija in lastnosti odpadne vode
Onesnažene odpadne vode mineralnega, organskega in bakterijskega izvora pridejo v kanalizacijsko omrežje.
Gospodinjska odpadna voda vključuje vodo, odstranjeno iz stranišč, kopalnic, prh, kuhinj, kopališč, pralnic, menz in bolnišnic. Onesnažujejo jih predvsem fiziološki odpadki in gospodinjski odpadki.
Industrijska odpadna voda je voda, ki se uporablja v različnih tehnoloških procesih (na primer za pranje surovin in končnih izdelkov, hlajenje termoagregatov itd.), pa tudi voda, ki se pri rudarjenju črpa na zemeljsko površje. Industrijska odpadna voda iz številnih industrij je onesnažena predvsem z industrijskimi odpadki, ki lahko vsebujejo strupene snovi (na primer cianovodikova kislina, fenol, arzenove spojine, anilin, bakrove soli, svinec, živo srebro itd.), pa tudi snovi, ki vsebujejo radioaktivne snovi. elementi; nekateri odpadki imajo določeno vrednost (kot sekundarne surovine). Glede na količino nečistoč delimo industrijsko odpadno vodo na onesnaženo, ki je pred izpustom v rezervoar (ali pred ponovno uporabo) podvržena predobdelavi, in pogojno čisto (lahko onesnaženo), izpuščeno v rezervoar (ali ponovno uporabljeno v proizvodnji). ) brez zdravljenja.
Atmosferska odpadna voda - deževnica in talina (nastala kot posledica taljenja ledu in snega). V to kategorijo po kvalitativnih značilnostih onesnaženosti spada tudi voda iz zalivanja ulic in zelenic. Atmosferska odpadna voda, ki vsebuje pretežno mineralne onesnaževalce, je v sanitarnem smislu manj nevarna kot gospodinjska in industrijska odpadna voda.
Stopnjo onesnaženosti odpadne vode ocenjujemo s koncentracijo nečistoč, to je z njihovo maso na prostorninsko enoto (v mg/l ali g/m3).
Sestava gospodinjske odpadne vode je bolj ali manj enotna; koncentracija onesnaževalcev v njih je odvisna od količine porabljene vode iz pipe (na prebivalca), to je od stopnje porabe vode. Onesnaževalce gospodinjske odpadne vode običajno delimo na: netopne, ki tvorijo velike suspenzije (pri katerih velikost delcev presega 0,1 mm) ali suspenzije, emulzije in pene (pri katerih so velikosti delcev od 0,1 mm do 0,1 μm), koloidne (pri katerih so delci velikosti od 0,1 mikronov do 1 nm), topni (v obliki molekularno razpršenih delcev, manjših od 1 nm).
V gospodinjskih odpadnih vodah so različna onesnaževala: mineralna, organska in biološka. Mineralni onesnaževalci vključujejo pesek, delce žlindre, delce gline, raztopine mineralnih soli, kislin, alkalij in številne druge snovi. Organsko onesnaženje je lahko rastlinskega ali živalskega izvora. Zelenjava vključuje rastlinske ostanke, sadje, zelenjavo, papir, rastlinska olja itd. Glavni kemični element rastlinskih onesnaževal je ogljik.
Onesnaževala živalskega izvora so fiziološki izločki ljudi in živali, ostanki živalskega tkiva, lepila ipd. Zanje je značilna visoka vsebnost dušika. Biološki onesnaževalci vključujejo različne mikroorganizme, kvasovke in plesni, majhne alge, bakterije, vključno s patogenimi (povzročitelji tifusa, paratifusa, griže, antraksa itd.). Tovrstno onesnaženje ni značilno samo za gospodinjske odpadne vode, temveč tudi za nekatere vrste industrijskih odpadnih voda, na primer v mesnopredelovalnih obratih, klavnicah, usnjarnah, biotovarnah itd. Po kemijski sestavi so organska onesnaževala, vendar jih ločimo v posebno skupino zaradi sanitarne nevarnosti, ki jo povzročajo ob izpustu v vodna telesa.
Gospodinjska odpadna voda vsebuje približno 42% mineralnih snovi (od skupne količine onesnaževal), organske snovi - približno 58%; oborjene suspendirane snovi predstavljajo 20%, suspenzije - 20%, koloidi - 10%, topne snovi - 50%.
Sestava in stopnja onesnaženosti industrijskih odpadnih voda je zelo raznolika in odvisna predvsem od narave proizvodnje in pogojev uporabe vode v tehnoloških procesih.
Količina atmosferske vode se močno razlikuje glede na podnebne razmere, teren, naravo urbanega razvoja, vrsto cestne površine itd. Tako lahko v mestih evropskega dela Rusije odtok deževnice v povprečju enkrat na leto doseže 100- 150 l/s 1 ha. Letni odtok deževnice iz pozidanih območij je 7-15-krat manjši od odtoka sanitarne vode.
Fizikalno stanje odpadne vode je treh vrst:Tabela 1. Kemikalije, ki jih prispeva onesnaženje na osebo
Sestava odpadne vode
Bakterijska kontaminacija odpadne vode
Rezervoar kot sprejemnik odpadne vode
Metode čiščenja EPS
Čisto in rahlo onesnaženo vodo lahko pošljete v sistem za recikliranje vode ali uporabite za redčenje onesnažene vode, da zmanjšate koncentracijo onesnaženja. Ločeno odvajanje ESW in ločeno čiščenje teh voda po eni ali drugi metodi se pogosto uporablja pred izpustom v rezervoar. To je ekonomsko upravičeno.
Čiste vode, ki se običajno uporabljajo za hlajenje;
Rahlo onesnažene ali razmeroma čiste vode, ki nastanejo pri pranju končnih izdelkov;
Umazane vode.
Če se uporabljata skupaj, se metoda čiščenja in nevtralizacije odpadne vode imenuje kombinirana. Uporaba določene metode v vsakem posameznem primeru je odvisna od narave kontaminacije in stopnje škodljivosti nečistoč.
Mehansko čiščenje.
Fizikalno-kemično čiščenje.
Kemično čiščenje.
Biološko zdravljenje.
1.6.1. Mehansko čiščenje EPS
Mehansko čiščenje EPS je namenjeno ločevanju neraztopljenih in delno koloidnih primesi iz njih. Metode mehanskega čiščenja vključujejo: a) filtriranje; b) usedanje; c) filtriranje; d) odstranjevanje neraztopljenih nečistoč v hidrociklonih in centrifugah.
1.6.2. Fizikalno-kemijsko čiščenje EPS
1.6.3 Kemijska analiza EPS
Sestavo odpadne vode, celo njeno kakovost, je pogosto težko predvideti. To velja predvsem za odpadne vode po kemičnem in biokemičnem čiščenju, saj posledično nastajajo nove kemične spojine. Zato je treba praviloma najprej preveriti ustreznost tudi dokaj dobro preizkušenih metod za določanje posameznih komponent in analiznih shem.
Možnost 1
Vzorec nakisamo s H 2 SO 4 do rahlo kisle reakcije in oddestiliramo s paro, dokler ne dobimo majhnega ostanka.
Destilat 1: hlapne kisline in nevtralne snovi
Ostanek 1: nehlapne kisline, amin sulfati, fenoli in nevtralni
Ostanek 2: natrijeve soli hlapnih kislin, fenoli
Možnost 2
Vzorec se alkalinizira in oddestilira s paro, dokler ne nastane majhen ostanek.
Destilat 1: hlapne baze in nevtralne snovi
Ostanek 1: soli hlapnih in nehlapnih kislin
Nakisamo in oddestiliramo s paro, dokler ne dobimo majhnega ostanka.
Destilat 2: hlapne nevtralne spojine
Ostanek 2: soli hlapnih baz. Zmešamo in ekstrahiramo z etrom
Dodajte NaCl in HCl v vzorec (25-100 ml) odpadne vode, dokler nista nasičena do koncentracije ≈ 5 %.
Ekstrahirano z dietil etrom
Izvleček 1: nevtralne spojine, kisline. Trikrat obdelamo s 5% raztopino NaOH
Vodna faza 1: dodamo NaOH do pH ≥ 10, večkrat ekstrahiramo z etrom, ekstrakte združimo
Vodna faza 2: šibke kisline (predvsem fenoli). Nasičimo s CO 2, dokler se ne pojavi oborina NaHCO 3, obdelamo z več porcijami etra, ekstrakte združimo
Esencialni sloj: nevtralne snovi. Posušen brez Na 2 SO 4 eter oddestiliramo, suhi ostanek stehtamo, raztopimo v etru in prenesemo v kolono silikagela. Zaporedoma eluirajte z alifatsko spojino izooktan, aromatski benzen. Topilo se odpari iz vsakega eluata in ostanek se stehta.
Vodna faza 3: amfoterne nehlapne spojine, bolj topne v vodi kot v etru. Nevtraliziramo CH 3 COOH, ekstrahiramo z več porcijami etra, ekstrakte združimo
Bistvena plast: bazične spojine. Na 2 SO 4 posušimo, eter oddestiliramo, suhi ostanek stehtamo
Etrsko plast posušimo do suhega. Na 2 SO 4, eter oddestiliramo, suhi ostanek stehtamo
Vodna faza. Odstranite eter, nakisajte, obdelajte z več porcijami etra
Kombinirani izvlečki: amfoterne snovi. Na 2 SO 4 posušimo, eter oddestiliramo, suhi ostanek stehtamo
Vodna faza. Nakisamo na pH 3-4, odparimo do suhega. Ostanek je primeren za določanje ogljika
Etrsko plast posušimo z Na 2 SO 4 in eter oddestiliramo. Preostanek se stehta.
Vodno fazo zavržemo
Iz odpadne vode v površinske vode vstopajo bencin, kerozin, goriva in mazalna olja, benzen, toluen, maščobne kisline, fenoli, pesticidi, sintetični detergenti, organokovinske in druge organske spojine. Organske snovi v vzorcih odpadne vode, zbranih za analizo, se zlahka spremenijo s kemičnimi in biokemičnimi procesi, zato je treba zbrane vzorce analizirati čim hitreje. V tabeli 2, 3 prikazujeta shemi za ločevanje organskih snovi, prisotnih v odpadni vodi.
1.6.3.2 Določanje organskih spojin z masno spektrometrijo
Pri analizi odpadne vode so zmožnosti masne spektrometrije še posebej pomembne pri identifikaciji spojin neznane strukture in analizi kompleksnih zmesi, določanju mikrokomponent na ozadju spremljajočih snovi, katerih koncentracija je za velikostne rede višja od koncentracije komponent, ki so v odpadnih vodah. odločen. Tu so primerne GLC z MS, tandem MS, kombinacija HPLC in MS za analizo nehlapnih snovi ter metode mehke ionizacije in selektivne ionizacije.
1.6.3.3 Kemijske testne metode analize
Avtor: HNU Systems Inc. Proizvajajo testne komplete za določanje surove nafte, gorljivega goriva, odpadnega olja v zemlji in vodi. Metoda temelji na Friedel-Craftsovi alkilaciji aromatskih ogljikovodikov, ki jih najdemo v naftnih proizvodih, z alkilnimi halidi, da nastanejo obarvani produkti: 
Kot katalizator se uporablja brezvodni aluminijev klorid. Pri analizi vode se ekstrakcija izvaja iz 500 ml vzorca. Glede na določeno komponento se pojavijo naslednje barve izvlečka:
Barvne lestvice so sestavljene za vodo v območju 0,1 – 1 – 5 – 10 – 20 – 50 – 100 mg/l.
Benzen – rumen do oranžen;
Toluen, etilbenzen, ksilen - od rumeno-oranžne do svetlo oranžne;
Bencin - od bež do rdeče-rjave;
Dizelsko gorivo - od bež do zelene.
ArNH 2 + NaNO 2 + 2HCl → + Cl ¯ + NaCl + 2H 2 O,
Druga stopnja je kombinacija diazonijevih soli s fenoli v alkalnem mediju, kar vodi do tvorbe azo spojine:
+ Cl ¯ + Ph–OH → ArN=N–Ph–OH + HCl
Če je pozicija para zaprta, potem je oblikovana O-azo spojina:
O 2 N–Ph–NH 2 + BF 4 → BF 4
Za določanje fenola dodamo 1 kvadrat filtrirnega papirja, impregniranega z NDF, in 1 kvadrat papirja, impregniranega z mešanico natrijevega karbonata in cetilpiridinijevega klorida (CP) v 1 ml analizirane tekočine.
O 2 N–Ph–N≡N + + Ph–OH → O 2 N–Ph–N=N–Ph–OH O 2 N–Ph–N=N–Ph–O ¯ CPU +
O 2 N–Ph–N=N–Ph–O ¯ CPU +
Na določanje fenola ne vplivajo 50-kratne količine anilina. 2,4,6-substituirani fenoli, 2,4-substituirani 1-naftoli in 1-substituirani 2-naftoli ne motijo določanja. Določena območja vsebnosti fenola: 0,05 – 0,1 – 0,3 – 0,5 – 1 – 3 – 5 mg/l. Razviti testi so bili uporabljeni za določanje fenola v odpadni vodi.
2.1 Teoretične osnove metod za nadzor kakovosti čiščenja EPS
Za nadzor kakovosti čiščenja EPS je treba ustvariti posebne laboratorije, na primer industrijski sanitarni laboratorij.
2.1.1 Metoda plinske kromatografije
Analiziramo fenol in njegove derivate.
R  je. 4. Plinski kromatogram benzenskega ekstrakta mešanice fenolov iz vzorca odpadne vode: 1 – o-klorofenol; 2 – fenol; 3 – m-krezol; 4 – p-klorofenol.
je. 4. Plinski kromatogram benzenskega ekstrakta mešanice fenolov iz vzorca odpadne vode: 1 – o-klorofenol; 2 – fenol; 3 – m-krezol; 4 – p-klorofenol.
2.1.2 Metoda masne spektroskopije
zaključki
Razvoj okoljskih objektov ni mogoč brez ustrezne okoljske utemeljitve. Osnova te utemeljitve je ocena vpliva očiščene odpadne vode na sprejemne vode. Potreba po izvedbi dela za oceno stanja rezervoarjev in vodotokov je bila oblikovana konec prejšnjega stoletja.
2. Lurie Yu. Yu. Analitska kemija industrijske odpadne vode.
SNiP 2.04.02 – 84. Oskrba z vodo. Zunanja omrežja strukture - M .: Stroyizdat, 1985.